چرخه گلیاگزالات
چرخه گلیاگزالات گونهای از چرخه تریکربوکسیلیک اسید و مسیر آنابولیکی است که در گیاهان، باکتریها، آغازیان و قارچها رخ میدهد. چرخه گلیاگزالات بر تبدیل استیل-کوآ به سوکسینات در سنتز کربوهیدراتها متمرکز است.[1] چرخه گلیاگزالات هنگامی که در ریزاندامگان قندهای ساده همچون گلوکز و فروکتوز در دسترس نیستند، به سلولها اجازه میدهد برای برآوردن نیازهای کربن سلولی خود از دو کربن (ترکیبات C۲)، همانند استات، استفاده کنند.[2] ااین چرخه در جانوران به جز در مراحل آغازین جنینزایی کرمهای لولهای حضور ندارد. در سالهای اخیر ردیابی دو آنزیم کلیدی چرخه گلیاگزالات به نامهای مالات سنتاز (MS) و ایزوسیترات لیاز (ICL) در برخی از بافتهای جانوری سوالاتی را در رابطه با رابطه تکاملی آنزیمها در باکتریها و جانوران ایجاد کرده و پیشنهاد میکند که جانوران آنزیمهای جایگزین چرخه را رمزگذاری میکنند که از نظر کارکرد با MS و ICL شناختهشده در گونههای غیرجانوری متفاوت هستند.[1][3]
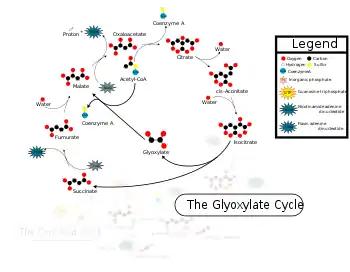
گیاهان، برخی از جلبکها و باکتریها میتوانند از استات به عنوان منبع کربن برای تولید ترکیبات کربن استفاده کنند. گیاهان و باکتریها برای ایجاد چهار اسید دیکربوکسیلیک کربن از دو واحد استات کربن، از گونهای از چرخه تریکربوکسیلیک اسید به نام چرخه گلیاگزالات استفاده میکنند. چرخه گلیاگزالات دو واکنش دکربوکسیلاسیون اکسیداتیو چرخه تریکربوکسیلیک اسید را دور زده و مستقیماً ایزوسیترات را از طریق ایزوسیترات لیاز و مالات سنتاز به مالات و سوکسینات تبدیل میکند.
شباهتها با چرخه اسید سیتریک
چرخه گلیاگزالات پنج آنزیم از هشت آنزیم چرخه اسید تریکربوکسیلیک را استفاده میکند: سیترات سینتاز، آکونیتاز، سوکسینات دهیدروژناز، فوماراز و مالات دهیدروژناز. تفاوت این دو چرخه این است که در چرخه گلیاگزالات، ایزوسیترات به جای اینکه به آلفا-کتوگلوتارات تبدیل شود، توسط ایزوسیترات لیاز (ICL) به گلیاگزالات و سوکسینات تبدیل میشود.[1] این کار مراحل کربوکسیلزدایی که در چرخه اسید سیتریک (چرخه TCA) انجام میشوند را دور میزند و اجازه میدهد که ترکیبات ساده کربن در سنتز بعدی درشتمولکولها مانند گلوکز به کار گرفته شوند.[2] در ادامه آنزیم مالات سنتاز، گلیاگزالات را با استیل-کوآ ترکیب میکند تا مالات تولید شود.[1] همزمان سوکسینات توسط آنزیمهای سوکسینات دهیدروژناز و فوماراز به مالات تبدیل میشود.
نقش در نوگلوکززایی
اسیدهای چرب حاصل از لیپیدها معمولاً به عنوان منبع انرژی توسط مهرهداران استفاده میشوند زیرا اسیدهای چرب از طریق اکسیداسیون بتا به مولکولهای استات تبدیل میشوند. این استات به گروه تیول فعال کوآنزیم آ میپیوندد و وارد چرخه اسید سیتریک (چرخه TCA) میشود تا بهطور کامل اکسایش یابد و به کربن دیاکسید تبدیل شود؛ بنابراین این مسیر به یاختهها اجازه میدهد تا از چربی، انرژی بگیرند. از چرخه گلیاگزالات که واکنشهای نخستین یکسانی با چرخه TCA دارد برای بهکارگیری استات حاصل از چربی برای بیوسنتز کربوهیدراتها، استفاده میشود.
جانداران دارای دیواره باختهای مانند گیاهان، قارچها و باکتریها برای بیوسنتز پلیساکاریدهای ساختاری پیچیده مانند سلولز، گلوکانها و کیتین به مقدار زیادی کربوهیدرات در طول رشد و نمو احتیاج دارند. چرخه گلیاگزالات در این جانداران در نبود کربوهیدراتهای موجود (برای نمونه در برخی از محیطهای میکروبی یا هنگام جوانه زدن بذر در گیاهان) اجازه میدهد تا گلوکز از راه استات تولید شده در اکسیداسیون بتای اسید چرب لیپیدها تولید شود.
چرخه گلیاگزالات مراحلی از چرخه اسید سیتریک را دور میزند که در آن کربن به شکل CO2 از بین میرود. دو مرحله نخستین چرخه گلیاگزالات مانند چرخه اسید سیتریک هستند: استات ← سیترات ← ایزوسیترات. در مرحله بعدی، ایزوسیترات توسط نخستین آنزیم چرخه گلیاگزالات که ایزوسیترات لیاز است به سوکسینات و گلیاگزالات (نام چرخه از نام این ماده گرفته شدهاست) تجزیه میشود. مالات سنتاز، گلیاگزالات با استیل-کوآ را ترکیب میکند تا مالات به دست آید. مالات و اگزالواستات میتوانند توسط نخستین آنزیم نوگلوکززایی یعنی فسفوئنولپیرووات کربوکسیکیناز، به فسفوئنولپیرووات تبدیل شوند. نتیجه خالص چرخه گلیاگزالات تولید گلوکز از اسیدهای چرب است. سوکسینات تولید شده در مرحله نخست میتواند وارد چرخه اسید سیتریک شود تا در پایان اگزالواستات تشکیل شود.[2]
عملکرد در جانداران
گیاهان
در گیاهان چرخه گلیاگزالات در پراکسیزومهای ویژهای رخ میدهد که گلیاکسیزوم نامیده میشوند. این چرخه به دانهها اجازه میدهد تا از لیپیدها به عنوان یک منبع انرژی برای تشکیل شاخه در طول جوانهزنی استفاده کنند. دانه نمیتواند زیستتوده را با استفاده از فتوسنتز بسازد زیرا اندامی برای انجام این کار ندارد. از ذخایر چربی دانههای درحال رویش برای ساخت کربوهیدراتهایی که به رشد و نمو جاندار کمک میکنند، استفاده میشود.
چرخه گلیاگزالات همچنین میتواند جنبه دیگری از گوناگونی متابولیکی را در اختیار گیاهان قرار دهد. این چرخه به گیاهان اجازه میدهد که استات را هم به عنوان منبع کربن و هم به عنوان منبع انرژی جذب کنند. در چرخه گلیاگزالات همانند چرخه TCA، استات به استیل-کوآ تبدیل میشود. استیل-کوآ میتواند از چرخه گلیاگزالات بگذرد و مقداری سوکسینات در طول چرخه آزاد میشود. چهار مولکول سوکسینات کربن میتوانند از راه ترکیبهای دیگر فرآیندهای متابولیکی به انواع کربوهیدراتها تبدیل شوند. این گیاه میتواند مولکولهایی را با استفاده از استات به عنوان یک منبع برای کربن بسازد. استیل-کوآ همچنین میتواند با گلیاگزالات واکنش دهد و مقداری NADPH از +NADP تولید کند، که برای هدایت سنتز انرژی به شکل ATP بعداً در زنجیره انتقال الکترون استفاده میشود.[4]
قارچهای بیماریزا
چرخه گلیاگزالات ممکن است در برخی از گونههای قارچ بیماریزا با هدفی کاملاً متفاوت عمل کند. سطح آنزیمهای اصلی چرخه گلیاگزالات یعنی ICL و MS، در اثر تماس با میزبان انسانی بسیار افزایش مییابد. جهشهای گونهای خاص از قارچها که فاقد ICL هستند نیز در مقایسه با نوع وحشی، در مطالعات انجام شده با موشها به میزان قابل توجهی کم خطر هستند. ارتباط دقیق میان این دو مشاهده هنوز در حال بررسی است، اما میتوان نتیجه گرفت که چرخه گلیاگزالات عامل مهمی در بیماریزایی این میکروبها است.[5][6]
مهرهداران
زمانی تصور میشد که مهرهداران قادر به انجام این چرخه نیستند زیرا هیچ ردی از دو آنزیم اصلی آن یعنی ایزوسیترات لیاز و مالات سنتاز وجود نداشت. با این حال، برخی از پژوهشها نشان میدهند که این مسیر ممکن است در برخی از مهرهداران وجود داشته باشد.[7][8] بهطور خاص، برخی بررسیها شواهدی از وجود میزان قابل توجهی از اجزای چرخه گلیاگزالات در بافت کبد جوجهها را نشان میدهند. دادههایی از این دست این ایده را پشتیبانی میکنند که از لحاظ نظری این چرخه میتواند حتی در پیچیدهترین مهرهداران نیز رخ دهد.[9] آزمایشهای دیگر نیز شواهدی را مبنی بر وجود این چرخه در میان برخی گونههای حشرات و بیمهرگان دریایی و نیز شواهدی قوی از وجود این چرخه در گونههای کرم لولهای ارائه دادهاند. با این حال، آزمایشهای دیگر این ادعا را رد میکنند.[10] برخی از نشریات کشمکشهایی دربارهٔ وجود چرخه در پستانداران دارند: برای نمونه، یک مقاله بیان کردهاست که چرخه گلیاگزالات در خرسهای در خواب زمستانی، فعال است،[11] اما این گزارش در مقاله بعدی مورد بحث قرار گرفت.[12] شواهدی مبنی بر عملکرد مالات سنتاز در انسان وجود دارد که ناشی از فعالیت دوگانه مالات/بی-متیلمالات سنتاز با منشأ میتوکندریایی است که CLYBL نامیده و در بافت چربی قهوهای و کلیه بیان میشود.[13] ویتامین دی ممکن است این مسیر را در مهرهداران تنظیم کند.[9][14]
مهار چرخه گلیاگزالات
با توجه به نقش اصلی چرخه گلیاگزالات در سوخت و ساز گونههای بیماریزا از جمله قارچها و باکتریها، آنزیمهای چرخه گلیاگزالات اهداف بازدارندگی جاری برای درمان بیماریها هستند. بیشتر بازدارندههای گزارش شده از چرخه گلیاگزالات، اولین آنزیم چرخه (ICL) را هدف قرار میدهند. بازدارندههای کاندیدا آلبیکانس برای استفاده بالقوه به عنوان عوامل ضد قارچ گزارش شدهاند.[15] چرخه مایکوباکتریوم گلیاگزالات نیز برای درمانهای بالقوه سل مورد هدف قرار میگیرد.[16][17]
مفاهیم مهندسی
امروزه، چشمانداز طراحی مسیرهای سوختوساز پرشمار در پستانداران که فاقد آنها هستند، موضوعی مورد توجه مهندسان زیستی است. چرخه گلیاگزالات یکی از مسیرهایی است که مهندسان تلاش کردهاند تا آن را با دستکاری در یاختههای پستانداران نیز به راه بیاندازند. در آغاز این کار برای افزایش تولید پشم گوسفندان که محدود به دسترسی به انبارهای گلوکز است، مورد توجه مهندسان قرار گرفت. با معرفی این مسیر به یاختههای گوسفند، میتوان از ذخایر بزرگ استات یاختهها برای ساخت گلوکز در چرخه استفاده کرد و تولید پشم را افزایش داد.[18] پستانداران به دلیل نداشتن دو آنزیم ایزوسیترات لیاز و مالات سنتاز که برای ایجاد چرخه مورد نیاز هستند، نمیتوانند این مسیر را اجرا کنند. برخی بر این باورند که ژنهای ساخت این آنزیمها در پستانداران شبهژن هستند؛ به این معنا که ژن لزوماً غایب نیست، بلکه صرفاً «خاموش» است.[1]
برای مهندسی مسیر در یاختهها، ژنهای مسئول رمزگذاری آنزیمها باید جدا و توالییابی شوند، که این کار با استفاده از باکتری اشریشیا کلی صورت گرفت که از آن ژن AceA مسئول کدگذاری برای ایزوسیترات لیاز و ژن AceB مسئول کدگذاری برای مالات توالییابی شد.[18] مهندسان توانستهاند ژنهای AceA و AceB را با موفقیت در یاختههای پستانداران بگنجانند و یاختهها نیز در ترجمه و رونویسی ژنها به آنزیمهای مناسب موفق بودند. این کار ثابت میکند که ژنها میتوانند بدون آسیب رساندن به کارکرد یا سلامت یاخته، با موفقیت در دنای یاخته قرار گیرند. با این حال، ثابت شدهاست که مهندسی مسیر در موشهای تراژنی، برای مهندسان دشوار است. با اینکه دنای در برخی از بافتها از جمله کبد و روده کوچک در جانوران آزمایش شده بیان شدهاست، سطح بیان آن چندان زیاد نیست و از نظر آماری قابل توجه نیست. مهندسان به منظور مهندسی موفق مسیر باید ژن را با پروموترهایی ترکیب کنند تا سطح بیان آن افزایش یابد و در یاختههای مناسب مانند یاختههای پوششی بیان شود.[19]
تلاشها برای مهندسی مسیر در جانوران پیچیدهتر مانند گوسفند، مؤثر نبودهاست. این به ما دو نکته را نشان میدهد؛ نخست اینکه باید پژوهشهای بیشتری دربارهٔ این موضوع انجام شود و دوم اینکه که ممکن است بیان زیاد چرخه در جانوران توسط شیمی یاخته تحمل نشود. گنجاندن چرخه در پستانداران از پیشرفت فناوری انتقال هستهای بهرهمند خواهد شد، که به مهندسین امکان میدهد تا پیش از انتقال به جانوران، مسیر ادغام کارکردی درون ژنوم را بررسی کنند و به آن دسترسی داشته باشند.[18]
نبود چرخه در یاختههای پستانداران، برتریهای احتمالی دارد. این چرخه در میکروارگانیسمهایی که باعث بیماری میشوند وجود دارد اما در پستانداران، برای نمونه در انسان وجود ندارد. برای ساخت آنتیبیوتیکها یک دلیل محکم وجود دارد و آن این است که آنها چرخه گلیاگزالات را مختل میکنند تا میکروارگانیسمهای بیماریزا را که برای زنده ماندن به این چرخه نیاز دارند را نابود کنند. اما به دلیل نبود چرخه گلیاگزالات و آنزیمهای آن، به انسان آسیبی وارد نمیکنند.[2]
منابع
- Kondrashov FA, Koonin EV, Morgunov IG, Finogenova TV, Kondrashova MN (October 2006). "Evolution of glyoxylate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation". Biology Direct. 1: 31. doi:10.1186/1745-6150-1-31. PMC 1630690. PMID 17059607.
- Lorenz MC, Fink GR (October 2002). "Life and death in a macrophage: role of the glyoxylate cycle in virulence". Eukaryotic Cell. 1 (5): 657–62. doi:10.1128/EC.1.5.657-662.2002. PMC 126751. PMID 12455685.
- Popov, EA; Moskalev, EA; Shevchenko, MU; Eprintsev, AT (November 2005). "Comparative analysis of glyoxylate cycle key enzyme isocitrate lyase from organisms of different systematic groups". Journal of Evolutionary Biochemistry and Physiology. 41 (6): 631–639. doi:10.1007/s10893-006-0004-3.
- Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry. New York: W. H. Freeman.
- Lorenz MC, Fink GR (July 2001). "The glyoxylate cycle is required for fungal virulence". Nature. 412 (6842): 83–6. doi:10.1038/35083594. PMID 11452311.
- Dunn MF, Ramírez-Trujillo JA, Hernández-Lucas I (October 2009). "Major roles of isocitrate lyase and malate synthase in bacterial and fungal pathogenesis". Microbiology. 155 (Pt 10): 3166–75. doi:10.1099/mic.0.030858-0. PMID 19684068.
- V. N. Popov; E. A. Moskalev; M. U. Shevchenko; A. T. Eprintsev (December 2005). "Comparative Analysis of Glyoxylate Cycle Key Enzyme Isocitrate Lyase from Organisms of Different Systematic Groups". Journal of Evolutionary Biochemistry and Physiology. 41 (6): 631–639. doi:10.1007/s10893-006-0004-3.
- Davis WL, Goodman DB (December 1992). "Evidence for the glyoxylate cycle in human liver". The Anatomical Record. 234 (4): 461–8. doi:10.1002/ar.1092340402. PMID 1456449.
- Davis WL, Jones RG, Farmer GR, Dickerson T, Cortinas E, Cooper OJ, Crawford L, Goodman DB (July 1990). "Identification of glyoxylate cycle enzymes in chick liver--the effect of vitamin D3: cytochemistry and biochemistry". The Anatomical Record. 227 (3): 271–84. doi:10.1002/ar.1092270302. PMID 2164796.
- Storrey, Kenneth, ed. (2004). Functional Metabolism: Regulation and Adaption. Hobocken, New Jersey: John Wiley and Sons, Inc. pp. 221–223. ISBN 978-0-471-41090-4.
- Davis WL, Goodman DB, Crawford LA, Cooper OJ, Matthews JL (March 1990). "Hibernation activates glyoxylate cycle and gluconeogenesis in black bear brown adipose tissue". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1051 (3): 276–8. doi:10.1016/0167-4889(90)90133-X. PMID 2310778.
- Jones JD, Burnett P, Zollman P (October 1999). "The glyoxylate cycle: does it function in the dormant or active bear?". Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 124 (2): 177–9. doi:10.1016/S0305-0491(99)00109-1. PMID 10584301.
- Strittmatter L, Li Y, Nakatsuka NJ, Calvo SE, Grabarek Z, Mootha VK (May 2014). "CLYBL is a polymorphic human enzyme with malate synthase and β-methylmalate synthase activity". Human Molecular Genetics. 23 (9): 2313–23. doi:10.1093/hmg/ddt624. PMC 3976331. PMID 24334609.
- Davis WL, Jones RG, Farmer GR, Cortinas E, Matthews JL, Goodman DB (1989). "The glyoxylate cycle in rat epiphyseal cartilage: the effect of vitamin-D3 on the activity of the enzymes isocitrate lyase and malate synthase". Bone. 10 (3): 201–6. doi:10.1016/8756-3282(89)90054-9. PMID 2553083.
- Cheah HL, Lim V, Sandai D (Apr 2014). "Inhibitors of the glyoxylate cycle enzyme ICL1 in Candida albicans for potential use as antifungal agents". PLOS ONE. 9 (4): e95951. Bibcode:2014PLoSO...995951C. doi:10.1371/journal.pone.0095951. PMC 4004578. PMID 24781056.
- Bhusal RP, Bashiri G, Kwai BX, Sperry J, Leung IK (July 2017). "Targeting isocitrate lyase for the treatment of latent tuberculosis". Drug Discovery Today. 22 (7): 1008–1016. doi:10.1016/j.drudis.2017.04.012. PMID 28458043.
- Lee YV, Wahab HA, Choong YS (2015). "Potential inhibitors for isocitrate lyase of Mycobacterium tuberculosis and non-M. tuberculosis: a summary". BioMed Research International. 2015: 895453. doi:10.1155/2015/895453. PMC 4306415. PMID 25649791.
- Ward KA (March 2000). "Transgene-mediated modifications to animal biochemistry". Trends in Biotechnology. 18 (3): 99–102. doi:10.1016/S0167-7799(99)01417-1. PMID 10675896.
- Ward, Kevin; C. D. Nancarrow (1 Sep 1991). "The genetic engineering of production traits in domestic animals". Cellular and Molecular Life Sciences. 47 (9): 913–922. doi:10.1007/BF01929882. PMID 1915775.
.svg.png.webp)