واکنش سیگماتروپی
واکنش سیگماتروپی (به انگلیسی: Sigmatropic reaction) یکی از انواع واکنشهای پریسیکلیک محسوب میشود که در نتیجه انجام آن یکی از پیوندهای سیگمای مولکول پیشماده طی واکنشی درون مولکولی و بدون نیاز به کاتالیزور به یک پیوند سیگمای دیگر تبدیل میشود (موقعیت پیوند سیگما تغییر میکند)[1] واژه سیگماتروپی ترکیبی از دو واژه است، سیگما (Sigma) که به صورت سنتی نماینده پیوند کربن-کربن در شیمی است و تروپی که برگرفته از واژه یونانی تروپوس (Tropos) به معنای چرخش و تبدیل است. واکنش سیگماتروپی را عملاً میتوان نوعی واکنش بازآرایی به شمار آورد، چرا که طی آن یک اتم یا گروه استخلاف شده برروی مجموعهای پیوندهای پای (π) مزدوج جداشده و به صورت دورن مولکولی و همزمان به سمت دیگر سیستم مزدوج متصل میشود. [2] اگرچه واکنشهای سیگماتروپی در عمل میتوانند بدون کاتالیزور نیز انجام شوند با اینحال استفاده از کاتالیزورهای اسید لوئیس میتواند در انجام واکنش مورد استفاده قرار بگیرند. شناختهشدهترین موارد از واکنشهای سیگماتروپی عبارتاند از: بازآرایی [۳،۳] کوپ، بازآرایی کلایزن، بازآرایی کارول و سنتز ایندول فیشر.

کلیات واکنشهای سیگماتروپی
نامگذاری وودوارد-هافمن
در شیمی آلی، بازآراییهای سیگماتروپی با کمک یک روش نمایش پذیرفته شده و مختصر بهصورت [i، j] نمایش داده میشوند. منظور از عبارت آی (i) در این روش نمایش تعداد اتمهای گروه مهاجرت کنندهاست. عبارت جِی (j) نیز نمایانگر تعداد اتمهای موجود در زنجیره مزدوجی است که انتقال گروه در طول آن رخ دادهاست.[3]

نحوه انجام واکنش
اساساً، تمام انتقالهای سیگماتروپی به دو صورت رخ میدهند، آرایش فضایی گروه مهاجرتکننده در طی انجام واکنش یا حفظ و یا دچار وارونگی میشود. تعیین این موضوع به نوع همپوشانی اوربیتالی گروه مهاجرتکننده و سیستم مزدوج بستگی دارد.[4]

در زمان انجام واکنش سیگماتروپی، در مواردی که برای همپوشانی بهتر اوربیتالی، انتقال یک گروه به چرخش نیاز ندارد، انتقال با حفظ شیمی فضایی رخ میدهد و به این نوع جابهجایی، انتقال تکرخی (Suprafacial) گفته میشود. به این معنی که گروه مهاجرتکننده دقیقاً از همان سمتی که سیستم مزدوج را ترک کردهاست به سر دیگر سیستم مزدوج اضافه میشود (سمت موافق در صفحه تقارن مولکول). از طرف دیگر اگر در زمان انتقال، برای همپوشانی بهتر اوربیتالی، یک گروه مجبور به انجام چرخش باشد، شیمی فضایی گروه مهاجرت کننده دچار وارونگی میشود که به این نوع جابهجایی، انتقال دورخی (Suprafacial) اطلاق میشود. به این معنی که گروه مهاجرتکننده از سمت مخالفی که سیستم مزدوج را ترک کردهاست به سر دیگر سیستم مزدوج اضافه میشود (سمت موافق در صفحه تقارن مولکول).

قوانین انتخاب وودوارد-هافمن
برای پیشبینی اینکه یک واکنش سیگماتروپی چهنوع انتقالی (تکرخی یا دورخی) را در چه شرایطی (حرارتی یا نوری) انتخاب و درنتیجه منجر به کدام محصول میشود، میتوان از قوانین وودوارد-هافمن که در جدول زیر ارائه شدهاست، استفاده نمود. عبارتهای آی (i) و جی (J) در جدول، بهتریب اشاره به شیمی فضایی گروه مهاجرتکننده و سیستم غیرمزدوج در زمان انجام واکنش دارند.
| i + j | مجاز در شرایط حرارتی | مجاز در شرایط نوری |
|---|---|---|
| 4n | تکرخی (i) - دورخی (j) دورخی (i) - تکرخی (j) | تکرخی (i) - تکرخی (j) دورخی (i) - دورخی (j) |
| 4n+2 | تکرخی (i) - تکرخی (j) دورخی (i) - دورخی (j) | تکرخی (i) - دورخی (j) دورخی (i) - تکرخی (j) |
انواع واکنشهای سیگماتروپی
جابهجایی گرمایی هیدرید
در یک جابهجایی گرمایی [۳،۱] هیدرید، یک اتم هیدروژن به صورت یک یون هیدرید در طول یک سیستم سه اتمی حرکت میکند. مطابق قوانین وودوارد–هافمن این انتقال بهصورت دورخی انجام میشود. اگرچه چنین انتقالی، همانطور که قوانین وودوارد–هافمن اعلام میکنند، از لحاظ تقارنی و همپوشانی اوربیتالی مجاز است، اما برای چنین انتقالی به یک توپولوژی تابخورده مانند نوار موبیوس (به انگلیسی: Mobius topology) نیاز است که اتخاذ چنین آرایشی برای یک اتم هیدروژن، بهخاطر کوچکی بیش از حد ابعاد اتم و دامنه پوشش اوربیتال مستقر بر روی آن (اوربیتال s)، غیرممکن است.[4]
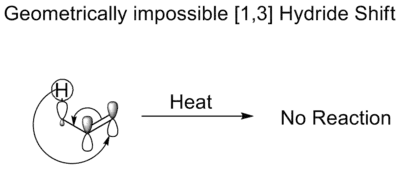 جابهجایی گرمایی [۳،۱] هیدرید
جابهجایی گرمایی [۳،۱] هیدرید
جابهجایی گرمایی آلکیل
جابهجایی گرمایی [۳،۱] آلکیل، نیز مشابه جابهجایی گرمایی [۳،۱] هیدرید، بهصورت دورخی انجام میشود. در اینجا نیز نیز به آرایش تاب خورده وجود دارد، با اینحال گروه آلکیل به خاطر ابعاد و دامنه پوشش اوربیتالی وسیعتر (اوربیتال sp3) امکان اتخاذ چنین آرایشی را دارا است. شکلگیری چنین آرایش تابخوردهای موجب وارونگی گروه آلکیل و درنتیجه وارونگی شیمی فضایی آن میشود.[4]
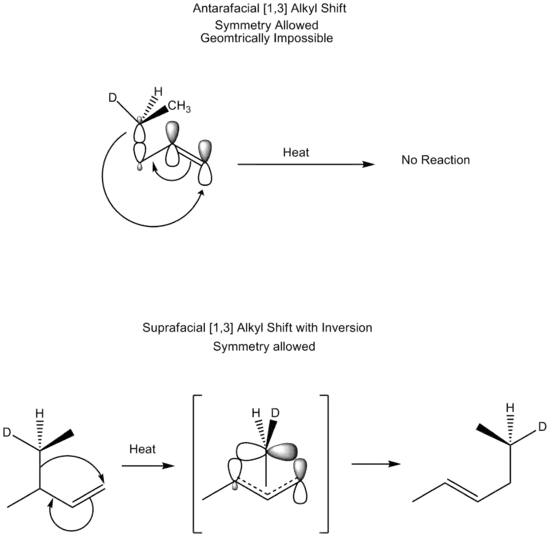 جابهجایی گرمایی [۳،۱] آلکیل
جابهجایی گرمایی [۳،۱] آلکیل
جابهجایی نوری
جابهجایی نوری یا اصطلاحاً فوتوشیمیایی از نوع [۳،۱]، برخلاف جابهجاهای گرمایی از طریق مسیر تکرخی به پیش میرود. علت این چنین تفاوت عملکردی این است که نور موجب انتقال الکترون قرار گرفته در اوربیتال هومو (Homo) به اوربیتال مولکولی لومو (Lumo) میشود، درنتیجه نوع همپوشانی مورد نیاز برای انتقال گروه نیز تغییر میکند و انتقال تکرخی که تا قبل از آن ممنوع بود، مجاز میشود.[4]
جابهجایی [۵،۱]
یک جابهجایی [۵،۱] شامل انتقال یک اتم/گروه (هیدروژن، آلکیل یا آریل) در طول یک سیستم پنج اتمی پای است. این نوع انتقال بهصورت تکرخی و بدون نیاز به چرخش توپولوژی انجام میشود. زمانیکه توپولوژی اتخاذ شده در زمان انتقال بدون تابخوردگی باشد، اصطلاحاً به آن توپولوژی هوکل (به انگلیسی: Hückel topology) گفته میشود.
 جابهجایی گرمایی [۵،۱] آلکیل
جابهجایی گرمایی [۵،۱] آلکیل
جابهجایی نوری
مانند مورد جابهجایی [۳،۱]، در این مورد نیز چنانچه بهجای حرارت از نور برای انجام واکنش استفاده شود، مسیر انجام واکنش برعکس میشود. به این معنی که برخلاف مسیر حرارتی که یک انتقال [۵،۱] بهصورت تکرخی انجام میشود، انتقال [۵،۱] نوری، بهصورت دورخی بهپیش میرود.[5]
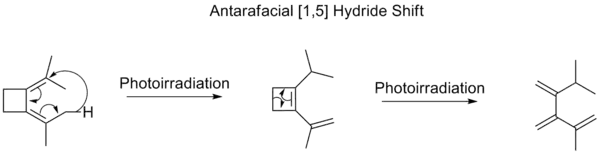 جابهجایی نوری [۵،۱] هیدرید
جابهجایی نوری [۵،۱] هیدرید
جابهجایی [۷،۱]
مطابق قوانین وودوارد-هافمن، یک جابهجایی [۷،۱] بهصورت دورخی و از طریق اتخاذ یک آرایش تابخورده موبیوسی انجام میشود. بهعنوان یک مثال، این نوع جابهجایی در تبدیل لومیسترول به ارگوکالسیفرول (ویتامین D2) مشاهده میشود.[6]
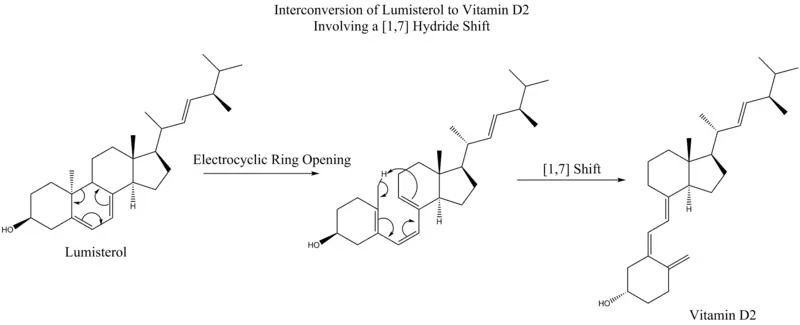
به عنوان مثالی دیگر، نوناتریان دوحلقهای (به انگلیسی: Bicyclic nonatrienes) نیز متحمل انجام جابهجایی [۷،۱] میشود.[7]

جابهجایی [۳،۳]
جابهجایی سیگماتروپی [۳،۳] از شناختهشدهترین واکنششهای سیگماتروپی هستند. مطابق قوانین وودوارد–هافمن این نوع انتقالها از طریق یک مسیری شش الکترونی و بهصورت تکرخی و از طریق توپولوژی هوکل بهپیش میرود.
بازآرایی کلایزن
یکی از مهمترین مثالهای کی جابهجایی سیگماتروپی [۳،۳]، بازآرایی کلایزن است که در سال ۱۹۱۲ توسط رینر لودویگ کلایزن کشف شد. این نوع بازآرایی که جزء واکنشهای تشکیل پیوند کربن–کربن محسوب میوشد، اولین نمونه ثبت شده از جابهجایی سیگماتروپی [۳،۳] است.[8] [9] [10]

بازآرایی کلایزن آروماتیک
بازآرایی ارتو–کلایزن یا بازآرایی کلایزن آروماتیک، همانند بازآرایی کلایزن، یک جابهجایی سیگماتروپی [۳،۳] است با این تفاوت که گروه مهاجرتکننده در طول یک سیستم مزدوج آروماتیک جابهجا میشود که در نهایت و بر اثر انجام یک توتومری کتو-انول، منجر به تولید یک محصول فنول دارای استخلاف در موقعیت ارتو میشود.
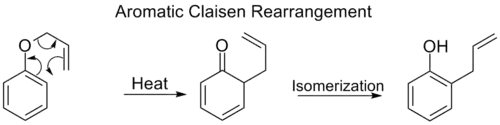 بازآرایی کلایزن آروماتیک
بازآرایی کلایزن آروماتیک
زمانیکه هر دو موقعیت ارتو بر روی حلقه بنزن اشغال شده باشد، پس از انجام یک بازآرایی ارتو–کلایزن، مجدداً یک بازآرایی ارتو–کلایزن دوم نیز رخ میدهد. به این نوع جابهجایی که شامل دو بازآرایی ارتو–کلایزن متوالی است، بازآرایی پارا کلایزن (به انگلیسی: para-Claisen rearrangement) گفته میشود. محصول نهایی یک فنول دارای استخلاف در موقعیت پارا است که بر اثر توتومری کتو-انول حدواسط سیکلوهگزادیانون تولید میشود
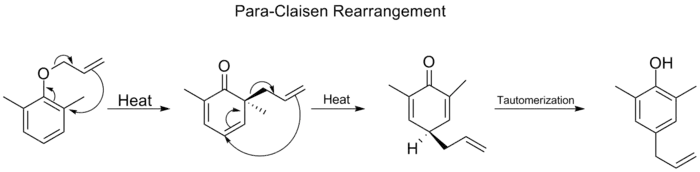 بازآرایی پارا کلایزن
بازآرایی پارا کلایزن
بازآرایی کوپ
بازآرایی کوپ یکی دیگر از انواع واکنشهای جابهجایی سیگماتروپی [۳،۳] است که بهطور گستردهای مورد مطالعه قرار گرفتهاست. این بازآرایی که شامل جابهجایی سیگماتروپی [۳،۳] یک مولکول ۵،۱-دیانون است، [11] [12] [13] توسط آرتور کلی کوپ توسعه داده شد.
 بازآرایی کوپ
بازآرایی کوپ
بازآرایی اکسی-کوپ
بازآرایی اکسی-کوپ (به انگلیسی: Oxy-Cope rearrangement)، کاملاً شبیه به بازآرایی کوپ است با این تفاوت که یک گروه هیدروکسیل در موقعیت کربن شماره ۳ حضور دارد که موجب میشود پس از انجام جابهجایی سیگماتروپی [۳،۳] یک حدواسط اِنول تولید شود. حداوسط اِنول تولیدی با انجام یک توتومری کتو-انول به کتون متناظر تبدیل میشود. [14]
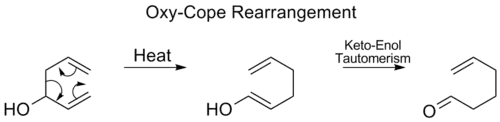 بازآرایی اکسی-کوپ
بازآرایی اکسی-کوپ
بازآرایی کارول
بازآرایی کارول یکی دیگر از انواع جابهجاییهای سیگماتروپی [۳،۳] است که طی آن یک بتا-کتو آلیل استر به یک آلفا-آلیل-بتا-کتوکربوکسیلیک اسید تبدیل میشود. حدواسط تولیدی در ادامه متحمل یک واکنش کربوکسیلزدایی شده و منجر به تولید یک انول میشود. اِنول تولیدی نیز در ادامه با انجام یک توتومری کتو-انول به کتون مربوط تبدیل میشود.
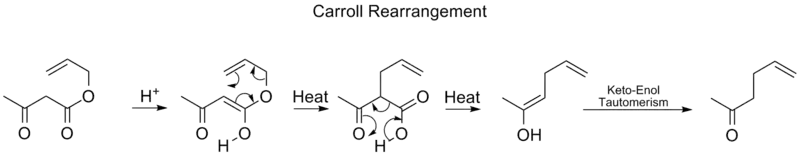 بازآرایی کارول
بازآرایی کارول
سنتز ایندول فیشر
سنتز ایندول فیشر روشی شناخته شده در تولید یک ایندول با استفاده از پیشمادههای فنیل هیدرازین و آلدهید (یا کتون) در شرایط اسیدی است. [15] [16] این واکنش که در سال ۱۸۸۳ توسط هرمان امیل فیشر کشف شد از جمله واکنشهایی است که طی آن شاهد انجام یک واکنش جابهجایی سیگماتروپی [۳،۳] هستیم.
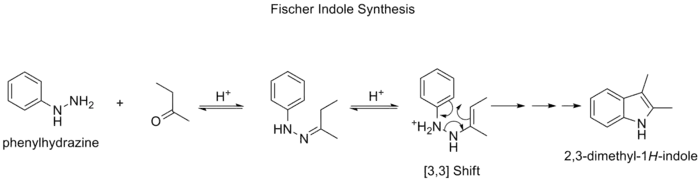 سنتز ایندول فیشر
سنتز ایندول فیشر
جابهجایی [۵،۵]
همانند جابهجایی [۳،۳]، در این مورد نیز قوانین وودوارد-هافمن پیشبینی میکند که یک جابهجایی سیگماتروپی [۵،۵] بهصورت تکرخی و از طریق اتخاذ توپولوژی توپولوژی هوکل انجام میشود. این واکنشها دارای گستردگی بسیار کمتری نسبت به واکنشهای جابهجایی [۳،۳] هستند. این موضوع، ریشه در این واقعیت دارد که تعداد مولکولهایی که توانایی انجام یک واکنش جابهجایی [۵،۵] را دارند بسیار کمتر از موارد مناسب برای جابهجایی [۳،۳] است.[4]
 جابهجایی [۵،۵]
جابهجایی [۵،۵]
جابهجایی [۳،۲]
یک نمونه بسیار شناخته شده از یک واکنش جابهجایی سیگماتروپی از نوع [۳،۲]، واکنش بازآرایی ۳،۲-ویتیگ است.
 بازآرایی ۳،۲-ویتیگ
بازآرایی ۳،۲-ویتیگ
جستارهای وابسته
منابع
- Carey, F.A. and R.J. Sundberg. Advanced Organic Chemistry Part A شابک ۰−۳۰۶−۴۱۱۹۸−۹
- "Sigmatropic Rearrangements". Chemistry LibreTexts.
- Woodward, R.B.; Hoffmann, R. The Conservation of Orbital Symmetry. Verlag Chemie Academic Press. 2004. شابک ۰−۸۹۵۷۳−۱۰۹−۶ .
- Miller, Bernard. Advanced Organic Chemistry. 2nd Ed. Upper Saddle River: Pearson Prentice Hall. 2004. شابک ۰−۱۳−۰۶۵۵۸۸−۰
- Kiefer, E.F.; Tana, C.H. J. Am. Chem. Soc., 1969, 91, 4478. doi:10.1021/ja01044a027
- Carey, Francis A; Sundberg, Richard J (2000). Advanced Organic Chemistry. Part A: Structure and Mechanisms (4th ed.). New York: Kluwer Academic/Plenum. p. 625. ISBN 0-306-46242-7.
- Klaerner, F.G. Agnew. Chem. Intl. Ed. Eng., 1972, 11, 832.doi:10.1002/anie.197208321
- Claisen, L.; Ber. 1912, 45, 3157. doi:10.1002/cber.19120450348
- Claisen, L.; Tietze, E.; Chemische Berichte 1925, 58, 275. doi:10.1002/cber.19250580207
- Claisen, L.; Tietze, E.; Chemische Berichte 1926, 59, 2344. doi:10.1002/cber.19260590927
- Cope, A. C.; et al. J. Am. Chem. Soc. 1940, 62, 441. doi:10.1021/ja01859a055
- Hoffmann, R.; Stohrer, W. D. J. Am. Chem. Soc. 1971, 93, 25, 6941–6948. doi:10.1021/ja00754a042
- Dupuis, M.; Murray, C.; Davidson, E. R. J. Am. Chem. Soc. 1991, 113, 26, 9756–9759. doi:10.1021/ja00026a007
- Berson, Jerome A.; Jones, Maitland. J. Am. Chem. Soc. 1964, 86, 22, 5019–5020. doi:10.1021/ja01076a067
- Fischer, E.; Jourdan, F. Chemische Berichte 1883, 16, 2241.doi:10.1002/cber.188301602141
- Fischer, E.; Hess, O. Chemische Berichte 1884, 17, 559. doi:10.1002/cber.188401701155
