اوربیتالهای مولکولی هومو و لومو
در شیمی، هومو (به انگلیسی: HOMO) مخففی برای عبارت بالاترین اوربیتال مولکولی پرشده (به انگلیسی: Highest occupied molecular orbital) و لومو (به انگلیسی: LUMO) مخففی برای عبارت پایینترین اوربیتال مولکولی پرنشده (به انگلیسی: Lowest unoccupied molecular orbital) هستند.
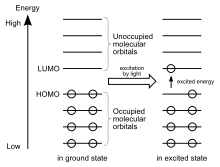


شکاف هومو–لومو
اختلاف انرژی بین اوربیتالهای هومو و لومو، اصطلاحاً شکاف هومو–لومو (به انگلیسی: HOMO–LUMO gap) نامیده میشود. در نظریه اوربیتال مولکولی مرزی، از این دو اوربیتال، بهعنوان اوربیتالهای مرزی یاد میشود. اختلاف انرژی میان این دو اوربیتال مرزی، میتواند برای پیشبینی استحکام و پایداری کمپلکسهای فلزات واسطه و همچنین رنگهایی که توسط آنها در محلول ایجاد میشود، مورد استفاده قرار گیرد. [1]
نیمههادیها
به صورت قیاسی میتوان اوربیتالهای هومو و لومو در نیمههادیهای آلی را به ترتیب با نوارهای ظرفیت و رسانش موجود در نیمههادیهای معدنی و نقاط کوانتومی معادل دانست.[2]
شیمی آلی فلزی
در شیمی آلی فلزی، از روی اندازه اوربیتال لومو میتوان محل اضافه شدن هستهدوست به لیگاند دارای پیوند پای را پیشبینی کرد.
سومو
سومو (به انگلیسی: SOMO) که مخففی برای عبارت اوربیتال مولکولی نیمه پرشده (به انگلیسی: Singly/Semi occupied molecular orbital) است همانند یک اوربیتال مولکولی هوموی نیمه پر است.[3]
جستارهای وابسته
منابع
- Griffith, J.S. and L.E. Orgel. "Ligand Field Theory". Q. Rev. Chem. Soc. 1957, 11, 381-383
- Bredas, J,-L. "Mind the gap!". Mater. Horiz. 2014,1, 17-19
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "SOMO".
