نوسان عصبی
نوسان عصبی یا موج مغزی، الگوهای ریتمیک یا تکراری فعالیت عصبی در سیستم عصبی مرکزی هستند. بافت عصبی میتواند فعالیتهای نوسانی را به طرق مختلف به وجود آورد، که به وسیله مکانیسم درون نورونهای فردی یا با تعامل بین نورونها هدایت میشود. در نورونهای فردی، نوسانات ممکن است به عنوان نوسان در پتانسیل غشا یا به عنوان الگوهای ریتمیک پتانسیلهای عمل عمل کنند، که پس از آن موجب فعال شدن نوسانات نورونها میشود. در سطح گروههای عصبی، فعالیت هماهنگ با تعداد زیادی از نورونها میتواند به نوسانات ماکروسکوپی منجر شود که میتواند در الکتروانسفالوگرام مشاهده شود. فعالیتهای نوسان در گروههای نورونی بهطور کلی از ارتباطات بازخورد بین نورونها ناشی میشود که منجر به هماهنگ سازی الگوهای شلیک آنها میشود. تعامل بین نورونها میتواند باعث افزایش نوسانات در فرکانسهای مختلف نسبت به فرکانس شلیک نورونهای فردی شود. یک مثال شناخته شده از نوسانات مغناطیسی عصبی فعالیت آلفا است. نوسانهای عصبی توسط محققان در اوایل سال ۱۹۲۴ (توسط هانس برگر) مشاهده شد. بیش از ۵۰ سال بعد، رفتار نوسانی ذاتی در عصبهای ستون مهره داران رخ داد، اما نقش عملکردی آن هنوز کاملاً درک نشدهاست.[1] نقش احتمالی نوسانهای عصبی شامل اتصال ویژگی، مکانیزم انتقال اطلاعات است. در دهههای گذشته، فهم این موضوع به دلیل پیشرفت در تصویربرداری مغز، بیشتر شدهاست. محدوده اصلی تحقیق در علوم اعصاب شامل تعیین اینکه چگونه نوسانات تولید میشوند و نقش آنها میباشد. فعالیتهای نوسان در مغز بهطور گستردهای در سطوح مختلف سازمان بندی میشود و به نظر میرسد نقش مهمی در پردازش اطلاعات عصبی داشته باشد.

تاریخچه
ریچارد کاتون فعالیت الکتریکی را در نیمکره مغزی خرگوش و میمون کشف کرد و یافتههایش را در سال ۱۸۷۵ منتشر کرد.[2] آدولف بک در سال ۱۸۹۰، مشاهدات خود را از فعالیت الکتریکی خودبخودی مغز خرگوش و سگ منتشر کرد که شامل نوسانهای ریتمیک که توسط نور تغییر یافته و به وسیله الکترودهای سطح مغز تشخیص داده شده بود.[3] قبل از هانس برگر، ولادیمیر ولدیمویوویچ اولین EEG حیوانات و توانایی تحریک شده از یک سگ را منتشر کرد.[4]
بررسی اجمالی
نوسانات عصبی در سراسر سیستم عصبی مرکزی و در تمام سطوح، و شامل، پتانسیل میدان محلی و در مقیاس بزرگ نوسانات که میتواند توسط اندازهگیریهای کامپیوتری (EEG)اندازهگیری شود. بهطور کلی، نوسانات را میتوان با فرکانس، دامنه و فاز آنها مشخص کرد. این خواص سیگنال میتواند از ضبطهای عصبی با استفاده از تجزیه و تحلیل فرکانس زمان استخراج شود. در نوسانات وسیع، تغییرات دامنه ای به دلیل تغییرات در هماهنگ سازی در یک گروه عصبی در نظر گرفته میشود که به عنوان هماهنگ سازی محلی نامیده میشوند. علاوه بر هماهنگ سازی محلی، فعالیت نوسانی ساختارهای عصبی (تک سلولی یا گروههای عصبی) هماهنگ میشوند. نوسانات عصبی و هماهنگ سازی با بسیاری از توابع شناختی مانند انتقال اطلاعات، ادراک، کنترل موتور و حافظه مرتبط است.[5][6][7]
نوسانهای عصبی در فعالیتهای عصبی تولید شده توسط گروههای بزرگ نورون بیشتر مورد مطالعه قرار گرفتهاند. فعالیتهای قوی مغز را میتوان با تکنیکهایی مانند EEG اندازهگیری کرد. بهطور کلی، سیگنالهای EEG دارای محتوای طیف گستردهای شبیه به نویز صورتی است، اما همچنین فعالیتهای نوسان در پهنای فرکانسی مشخص را نشان میدهد. اولین پهنای فرکانسی کشف شده و شناخته شده، فعالیت آلفا (۸ تا ۱۲ هرتز)[8] که میتواند در هنگام بیداری آرام از لوب آوندی مشاهده شود و هنگامی که چشم بستهاست، افزایش مییابد.[9] سایر باندهای فرکانس عبارتند از: دلتا (1 – ۴ هرتز)، تتا (4 – ۸ هرتز)، بتا (13 – ۳۰ هرتز)، گامای ضعیف(30 – ۷۰ هرتز) و گامای قوی (70 – ۱۵۰ هرتز). در واقع، سیگنال EEG بهطور چشمگیری در طول خواب تغییر میکند و انتقال از فرکانسهای بالا به فرکانسهای پایین مانند آلفا صورت میگیرد. در واقع، مراحل مختلف خواب معمولاً با محتوای طیفی EEG مشخص میشود.[10] در نتیجه، نوسانهای عصبی با حالتهای شناختی مانند آگاهی و خودآگاهی مرتبط است.[11][12]
گرچه نوسانات عصبی در فعالیت مغز انسان عمدتاً با استفاده از EEG بررسی میشود، اما همچنین با استفاده از تکنیکهای تهاجمی مانند ضبط تک واحد میتوان فعالیت مغز را مشاهده کرد. نورونها میتوانند الگوهای ریتمیک پتانسیلهای عمل و اسپایک تولید کنند. برخی از انواع نورونها تمایل به آتش در فرکانسهای خاص، به اصطلاح رزوناتور.[13] رگبار نورونی یکی دیگر از شکلهای ریتمیک است. فعالیت نوسانی نیز میتواند در شکل نوسانات پتانسیل غشاء زیر باند (یعنی عدم وجود پتانسیل عمل) مشاهده شود.[14] اگر عصبهای متعدد همزمان تحریک شوند، میتوانند موجب نوسان در پتانسیلهای محلی شوند. مدلهای کمی میتوانند قدرت نوسانهای عصبی را تخمین بزنند.[15]
نوسانهای عصبی معمولاً از یک چارچوب ریاضی مورد مطالعه قرار میگیرند و متعلق به حوزه "نورودینامیک"، محدوده تحقیقاتی در علوم شناختی است که متمرکز بر شخصیت پویا فعالیت عصبی در توصیف عملکرد مغز است.[16] که یک سیستم دینامیکی را در نظر میگیرد و از معادلات دیفرانسیل برای توصیف نحوه فعالیت عصبی در طول زمان استفاده میکند. و بهطور خاص، هدف آن است که الگوهای دینامیکی فعالیت مغز را به توابع شناختی مانند ادراک و حافظه مرتبط سازد. در شکل بسیار انتزاعی، نوسانات عصبی را میتوان با به صورت فرم بسته تحلیل کرد هنگامی که در یک محیط فیزیکی بیشتر واقع گرایانه مورد مطالعه قرار میگیرد، فعالیتهای نوسانی بهطور کلی با استفاده از شبیهسازی کامپیوتری یک مدل محاسباتی مورد مطالعه قرار میگیرد.
توابع نوسانهای عصبی گسترده هستند و برای انواع مختلف فعالیتهای نوسان متفاوت هستند. نمونههایی از تولید فعالیتهای ریتمیک مانند ضربان قلب و اتصال عصبی ویژگیهای حسی در درک، مانند شکل و رنگ یک شی است. نوسانهای عصبی نقش مهمی در بسیاری از اختلالات عصبی مانند هماهنگ سازی بیش از حد در طول فعالیت تشنج در صرع و ترمور در بیماران مبتلا به پارکینسون دارند. فعالیت نوسانی نیز میتوانید استفاده برای کنترل دستگاههای خارجی در رابط مغز و کامپیوتر، که در آن افراد میتوانند یک دستگاه خارجی را با مغز خود کنترل کنند.[17]
فیزیولوژی
فعالیتهای نوسان در سراسر سیستم عصبی مرکزی در تمام سطوح دیده میشود. سه سطح مختلف بهطور گسترده شناخته شدهاست: مقیاس میکرو (فعالیت یک نورون تک)، مقیاس مزو (فعالیت یک گروه محلی از نورون) و مقیاس بزرگ (فعالیت مناطق مختلف مغز).[18]
میکروسکوپیک
نورونها باعث ایجاد پتانسیل عمل میشوند که منجر به تغییر در پتانسیل غشای الکتریکی میشود. نورونها میتوانند پتانسیلهای عمل چندگانه را به ترتیب ایجاد کنند که به اصطلاح "اسپایک قطار" هستند. و باعث انتقال اطلاعات در مغز می شود. قطارهای اسپایک میتوانند انواع الگوهای مختلفی مانند ریتمیک و لرزان را تشکیل دهند و اغلب فعالیتهای نوسان را نشان میدهند.[19] فعالیت نوسان در نورونهای تک نیز میتواند در نوسانات زیر آستانه در پتانسیل غشا دیده شود. این تغییرات ریتمیک در پتانسیل غشاء به آستانه نمیرسند و بنابراین پتانسیل عمل را به وجود نمیآورند. آنها میتوانند از پتانسیلهای postynaptic از ورودیهای همزمان یا از ویژگیهای درونی نورونها حاصل شود.
اسپایکهای عصبی میتوانند از طریق الگوهای فعالیت آنها طبقهبندی شوند. تحریک پذیری نورونها میتواند در کلاسهای I و II تقسیم شود. نورونهای کلاس I میتوانند پتانسیلهای عمل را با فرکانس دلخواه کم با توجه به قدرت ورودی تولید کنند، در حالی که نورونهای کلاس II باعث ایجاد پتانسیل عمل در یک باند فرکانسی خاص میشوند که نسبت به تغییرات در قدرت ورودی نسبتاً غیر حساس است.[13] نورونهای کلاس II نیز بیشتر مستعد ابتلا به نوسانهای پائین آستانه در پتانسیل غشا هستند.
مزوسکوپیک
گروهی از نورونها همچنین میتوانند فعالیت نوسانی ایجاد کنند. از طریق تعاملات سیناپسی، الگوهای شلیک از نورونهای مختلف ممکن است هماهنگ و تغییرات ریتمیک در پتانسیل الکتریکی ناشی از پتانسیلهای عمل خود را (تداخل سازنده). به عبارت دیگر، الگوهای شلیک هماهنگ در نتیجه ورودی هماهنگ شده به دیگر مناطق قشر است که موجب نوسانات دامنه وسیع پتانسیل میدان محلی میشود. این نوسانات در مقیاس بزرگ نیز میتواند در خارج از پوست سر با استفاده از الکتروانسفالوگرافی (EEG) و مغناطیس فلاونوگرافی (MEG) اندازهگیری شود. پتانسیلهای الکتریکی تولید شده توسط نورونهای تک بسیار کوچک است که میتوانند خارج از پوست سر جمع شوند و فعالیت EEG یا MEG همواره منعکسکننده تقسیم فعالیتهای همزمان هزاران یا میلیونها نورون با جهتگیری فضایی مشابه است.[20] نورونها در یک گروه عصبی، به ندرت در همه لحظات آتش میزنند، بهطور کامل هماهنگ میشوند. در عوض، احتمال شلیک بهطور ریتمیک تعدیل شدهاست، به طوری که نورونها بیشتر در معرض آتشسوزی در یک زمان قرار میگیرند، که موجب نوسانات در فعالیت متوسط آنها میشود (شکل را در بالای صفحه ببینید). به همین ترتیب، فرکانس نوسانات وسیع در مقایسه با الگوی شلیک نورونهای فردی نیازی به مقایسه ندارد. نورونهای قشر جداگانه بهطور منظم تحت شرایط خاصی قرار میگیرند، اما در سلولهای مغز نخاعی با ورودیهای سیناپسی بسیار نوسان بمباران میشوند و بهطور ظاهری بهطور تصادفی آتش میزنند. با این حال، اگر احتمال یک گروه عظیم از نورونها به صورت ریتمیک در یک فرکانس رایج تغییر شکل داده شود، نوسانات در میدان متوسط تولید میشود (همچنین در بالای صفحه نیز شکل گرفتهاست).[19] گروههای عصبی میتوانند فعالیت نوسانی را به صورت درونزا از طریق تعاملات محلی بین نورونهای هیجان انگیز و مهارکننده تولید کنند. بهطور خاص، اینترنورونهای مهارکننده در ایجاد همگام سازی گروه عصبی نقش مهمی را در ایجاد یک پنجره باریک برای تحریک مؤثر و رونمایی از سرعت شلیک نورونهای تحریککننده ایفا میکنند.[21]
ماکروسکوپی
نوسان عصبی میتواند از تعامل بین نواحی مختلف مغز از طریق ساختاری به وجود آید کانکتوم. تاخیر زمانی در اینجا نقش مهمی دارد. از آنجاییکه همه قسمتهای مغز به دو طرف هدایت میکنند، این اتصالات بین زمینه مغز، حلقههای فیدبک را ایجاد میکنند. حلقههای مثبت فیدبک باعث ایجاد فعالیت نوسانی میشوند که در آن فرکانس به معکوس زمان تأخیر وابسته است. یک نمونه از چنین حلقه فیدبکی، اتصالات بین تالاموس و قشر میباشد - تابشهای تالاماکورتیکال. این شبکه تالاماکورتیکال قادر به تولید فعالیت نوسانی به نام تشدید تلاموپورکاتیک است.[22] شبکه تالاموکورتیک نقش مهمی در تولید فعالیت آلفا ایفا میکند.[23][24] در یک مدل شبکه مغز با اتصال واقعی آناتومیک و تأخیر انتشار در محدوده مغز، نوسانات در محدوده فرکانس بتا از هماهنگی جزئی از زیرمجموعه مناطق مغزی نوسان در گروه گاما (تولید شده در سطح mesoscopic) ظاهر میشود.[25]
مکانیسم ها
خواص نورون
دانشمندان برخی خصوصیات ذاتی عصبی را شناسایی کردهاند که نقش مهمی در تولید نوسانات بالقوه غشاء ایفا میکنند. بهطور خاص، کانالهای یونی وابسته به ولتاژ در تولید توان بالقوه عمل میکنند. پویایی این کانالهای یونی در مدل هوچکین-هاکسلی که به خوبی نشان میدهد که چگونه پتانسیلهای عمل با استفاده از مجموعه ای از معادلات دیفرانسیل آغاز و منتشر میشوند. با استفاده از تجزیه و تحلیل بیوگرافی، انواع مختلف نوسانی این مدلهای عصبی را میتوان تعیین کرد، که امکان طبقهبندی انواع واکنشهای عصبی را فراهم میکند. دینامیک نوسانات نورپردازی عصبی که در مدل هوچکین-هاکسلی شناسایی شدهاست، با نتایج تجربی همخوانی دارد. علاوه بر نوسانات دوره ای متقاطع غشاء، یعنی رفتارهای رزونانسی که به پتانسیل عمل منجر نمیشود، همچنین میتوانند فعالیتهای نوسان را با تسهیل فعالیتهای همزمان از نورونهای همسایه، در فعالیتهای نوسان کنند.[26][27] مانند نورونهای ضربان ساز در ژنراتورهای الگوی مرکزی، زیرمجموعههای سلولهای قشر، فورانهایی از سنبلهها (خوشههای کوتاه از سنبلهها) را به صورت ریتمیک در فرکانسهای ترجیح داده تولید میکنند. نورونهای انفجاری میتوانند به عنوان ضربان ساز برای نوسانات شبکههای همزمان عمل کنند و انفجارهای سنبله ممکن است موجب افزایش رزونانس نورونی شود.[19]
خواص شبکه
صرف نظر از خواص ذاتی نورون، خواص شبکه عصبی بیولوژیکی نیز یک منبع مهم فعالیت نوسان است. نورونها از طریق سیناپس با یکدیگر ارتباط برقرار میکنند و زمانبندی قطارهای سنبله در نورونهای پسین پدید میآید. بسته به خواص اتصال، از قبیل استحکام اتصال، تأخیر زمانی و اینکه آیا اتصال موجب تحریک یا مهار است، قطارهای سنبلههای نورونهای متصل شده میتوانند هماهنگ شوند.[28] نورونها به صورت محلی متصل میشوند و خوشههای کوچک تشکیل میشوند که گروههای عصبی نامیده میشوند. ساختارهای شبکه فعالیتهای نوسان خاصی را در فرکانسهای مشخص تولید میکنند. برای مثال، فعالیتهای عصبی توسط دو جمعیت از سلولهای مهار کننده و تحریک کننده مرتبط با یکدیگر میتوانند نوسانات خود به خود را نشان دهند که توسط مدل ویلسون-کوان توصیف میشود.[12]
اگر گروهی از نورونها در فعالیت نوسان همگام درگیر شوند، گروه عصبی میتواند به عنوان یک نوسانگر به صورت ریاضی نمایان شود.[18] گروههای عصبی مختلف از طریق اتصالات طولانی مدت پیوند داده میشوند و یک شبکه از اسیلاتورهای ضعیف مرتبط در مقیاس فضایی را تشکیل میدهند. اسیلاتورهای ضعیف میتوانند طیف وسیعی از دینامیک را شامل نوسان کنند.[29] اتصالات طولانی مدت بین ساختارهای مختلف مغز، مانند تالاموس و قشر مغز (با توجه به نوسانات تالاموکورتیک)، با توجه به سرعت هدایت سریع اکسونها، تأخیر زمانی را شامل میشوند. از آنجا که بیشتر اتصالات متقابل هستند، آنها حلقههای برگشتپذیر را پشتیبانی میکنند که فعالیتهای نوسانی را توجیه میکنند. نوسانات ثبت شده از مناطق مختلف قشر میتوانند همگام سازی شوند تا شبکههای بزرگ مغزی تشکیل دهند که دینامیک و قابلیت اتصال آنها را میتوان با استفاده از تحلیل طیفی و اقدامات علیت گرنجر مورد بررسی قرار داد.[30] فعالیت منسجم فعالیت مغز در مقیاس بزرگ میتواند پیوندهای پویا بین ارایههای مغز برای ادغام اطلاعات توزیع شود.
مدلسازی عصبی
علاوه بر تداخل مستقیم سیناپسی مستقیم بین نورونها که یک شبکه را تشکیل میدهند، فعالیت نوسانی توسط نورومودولاتورها در مقیاس زمان بسیار کندتر تنظیم میشود. بدین معنی است که سطوح غلظت برخی از انتقال دهندههای عصبی برای تنظیم مقدار فعالیت نوسانی شناخته شدهاست. به عنوان مثال، غلظت GABA بهطور پیوسته با فرکانس نوسانات در محرکهای القا شده ارتباط دارد.[31] تعدادی از هستهها در ساقه مغز و در همه سطوح مغز تأثیر میگذارند که تأثیر بالای انتقال دهندههای عصبی مانند نوراپی نفرین، استیل کولین و سروتونین را نشان میدهد. این سیستمهای انتقال دهنده عصبی بر وضعیت فیزیولوژیکی، مانند بیداری یا تحریک، تأثیر میگذارد و تأثیر مشخصی روی دامنه امواج مغزی مختلف مانند فعالیت آلفا دارد.[32]
شرح ریاضی
اغلب نوسانات را میتوان با استفاده از ریاضی توصیف و تحلیل کرد. ریاضیدانان چندین مکانیزم دینامیکی را شناسایی کردهاند که ریتمیکایی را تولید میکنند. در میان مهمترین نوسانگرهای هارمونیک (خطی)، نوسانگرای سیکل محدود و نوسانگرهای بازخورد با تأخیر است.[33] نوسانات هارمونیک بهطور طبیعی در طبیعت به نظر میرسد - نمونههایی از امواج صوتی، حرکت یک آونگ و ارتعاشات هر نوع است. آنها بهطور کلی هنگامی به وجود میآیند که یک سیستم فیزیکی با درجهٔ کوچک از حالت انرژی حداقل تحریک میشود و بهطور ریاضی به خوبی درک میشود. نوسانگرهای هارمونیک مبتنی بر نویز بهطور واقعی شبیهسازی ریتم آلفای در EEG بیداری و نیز امواج آهسته و اسپیندل در EEG خواب است. الگوریتمهای تحلیل EEG موفقیتآمیز بر اساس چنین مدلهایی بود. چندین اجزای EEG بیشتر با نوسانات محدودیت یا بازخورد بازخورد توصیف میشوند. نوسانات چرخهٔ محدودی از سیستمهای فیزیکی ناشی میشود که انحرافات زیادی از تعادل نشان میدهد، در حالی که نوسانات بازخورد تأخیر زمانی رخ میدهد که مؤلفههای یک سیستم پس از تأخیر زمانی معنی داری را تحت تأثیر قرار میدهند. نوسانات چرخه محدود میتواند پیچیده باشد اما ابزارهای ریاضی قدرتمند برای تحلیل آنها وجود دارد؛ ریاضیات نوسانات بازخورد تأخیری در مقایسه با ابتدایی است. نوسانگرهای خطی و اسیلاتورهای چرخه محدود، به لحاظ کیفی تفاوت در نحوه پاسخ آنها به نوسانات ورودی است. در یک نوسانگر خطی، فرکانس بیشتر یا کمتر ثابت است، اما دامنه آن میتواند به شدت متفاوت باشد. در یک اسیلاتور چرخه محدود، دامنه تمایل دارد بیشتر یا کمتر ثابت باشد، اما فرکانس میتواند به شدت متفاوت باشد. یک ضربان قلب، نمونه ای از نوسانات چرخه محدود است که فرکانس ضربهها بهطور گستردهای متفاوت است، در حالی که هر ضربات فردی همچنان به مقدار مشابه خون پمپ میکند.
مدلهای محاسباتی انواع انتزاعی را برای توصیف دینامیکی نوسان نوسانی مشاهده شده در فعالیت مغز اتخاذ میکنند. بسیاری از مدلها در این زمینه استفاده میشوند، هر کدام در یک سطح متفاوت انتزاع تعریف شده و سعی میکنند جنبههای مختلف سیستمهای عصبی را مدل کند. آنها از مدلهای رفتار کوتاه مدت نورونهای فردی، از طریق مدلهایی از چگونگی پویایی مدارهای عصبی حاصل از تعاملات بین نورونهای فردی، به مدلهای رفتار چگونه میتوانند از ماژولهای عصبی انتزاعی که نشان دهنده زیر سیستمهای کامل هستند، به وجود آورند.

مدل نورون تک
یک مدل از یک نورون بیولوژیکی یک توصیف ریاضی از خواص سلولهای عصبی یا نورونها است که برای توصیف و پیشبینی فرایندهای بیولوژیکی دقیق طراحی شدهاست. مدل موفقیتآمیز از نورونها، مدل Hodgkin-Huxley، بر اساس دادههای آکسون غول پیکر ماهی مرکب است. این مجموعه ای از معادلات دیفرانسیل معمولی غیر خطی است که تقریباً ویژگیهای الکتریکی یک نورون، به ویژه تولید و انتشار پتانسیلهای عمل است. این مدل بسیار دقیق است و هودگکین و هاکسلی جایزه نوبل سال ۱۹۶۳ در فیزیولوژی یا پزشکی را برای این کار دریافت کردند.
ریاضیات مدل هاجکین-هاکسلی کاملاً پیچیدهاست و چندین روش ساده مانند مدل فیتزوخ-ناگووم و مدل هندی-رول ارائه شدهاست. چنین مدلهایی فقط دینامیک پایه عصبی را جذب میکنند، مانند ریتمیک و لرزش، اما کارایی بیشتری در محاسبات دارند.
مدل اسپایکینگ
یک مدل شبکه عصبی، جمعیتی از نورونهای متصل شده فیزیکی یا گروهی از نورونهای متمایز را توصیف میکند که ورودیها یا اهداف سیگنال یک مدار قابل تشخیص را تعریف میکنند. این مدلها به منظور توصیف نحوه پویایی مدارهای عصبی از اثر متقابل بین نورونهای فردی، هدف میگیرند. تعاملات محلی بین نورونها میتواند منجر به هماهنگ سازی فعالیت اسپایکینگ شود و اساس فعالیتهای نوسان را تشکیل دهد. بهطور خاص، مدلهای سلولهای هرمی در تعامل و اینترنورونهای مهار شده برای تولید ریتمهای مغزی مانند فعالیت گاما نشان داده شده است.[34]

مدل توده عصبی
مدلهای میدان عصبی یکی دیگر از ابزار مهم در مطالعه نوسان عصبی هستند و یک چارچوب ریاضی هستند که تکامل متغیرهایی مانند سرعت متوسط شلیک در فضا و زمان را توصیف میکند. در مدلسازی فعالیت تعداد زیادی از نورونها، ایده مرکزی این است که چگالی نورونها را به محدوده پیوسته برسانیم، که در نتیجه شبکههای عصبی پیوسته پیوستهاست. به جای مدلسازی نورونهای فردی، این روش تقریباً یک گروه نورونی را با خواص متوسط و تعاملات آن تقسیم میکند. این بر اساس رویکرد میانگین میدانی، منطقه ای از فیزیک آماری است که با سیستمهای بزرگ مقیاس در ارتباط است. مدلهای مبتنی بر این اصول برای ارائه شرح ریاضی نوسانهای عصبی و ریتمهای EEG مورد استفاده قرار گرفتهاند. به عنوان مثال آنها برای بررسی توهمهای بصری مورد استفاده قرار میگیرند.[36]
مدل کوراموتو
مدل کومانتو از نوسانگرهای فاز متحرک[37] یکی از مدلهای انتزاعی و اساسی مورد استفاده برای بررسی نوسانات عصبی و هماهنگ سازی است. این فعالیت یک سیستم محلی (به عنوان مثال یک گروه نورون یا مجموعه عصبی) را به تنهایی توسط مرحله دایره ای آن تکهتکه میکند و از این رو دامنه نوسانات (دامنه ثابت) را نادیده میگیرد.[38] تعاملات میان این نوسانگرها به وسیلهٔ یک شکل جبری ساده (مانند یک تابع سینوسی) معرفی میشوند و در مجموع یک الگوی دینامیکی را در مقیاس جهانی ایجاد میکنند. مدل کوراموتو بهطور گستردهای مورد استفاده برای مطالعه فعالیتهای مغناطیسی است و چندین extensions ارائه شدهاست که باعث افزایش قابلیت اطمینان عصبی خود، به ویژه با ترکیب ویژگیهای توپولوژیکی اتصال کورتنی محلی.[39] بهطور خاص، آن را شرح میدهد که چگونه فعالیت یک گروه از نورونهای تعامل میتواند هماهنگ و تولید نوسانات در مقیاس بزرگ. شبیهسازی با استفاده از مدل کروموتو با ارتباط واقعی کروماتیک دراز مدت و تعامل با تأخیر زمانی، ظهور نوسانهای الگوی آرام را نشان میدهد که نقشههای عملکردی BOLD حالت استراحت را بازتولید میکند که میتواند با استفاده از fMRI اندازهگیری شود.[40]
الگوهای فعالیت
هر دو نورون مجزا و گروهی از نورونها میتوانند فعالیت نوسانی را بهطور خودبخودی تولید کنند. علاوه بر این، ممکن است واکنش نوسانی به ورودی ادراکی یا خروجی موتور نشان دهند. بعضی از انواع نورونها به صورت ریتمیک در صورت عدم وجود ورودیهای سیناپسی، به وجود میآیند. به همین ترتیب، فعالیت مغز گسترده فعالیت فعالیت نوسان را نشان میدهد در حالی که افراد در هیچ فعالیتی دخالت نمیکنند، به اصطلاح فعالیتهای حالت استراحت. این ریتمهای در حال انجام میتوانند در پاسخ به ورودی ادراکی یا خروجی موتور تغییری پیدا کنند. فعالیت نوسانی ممکن است با افزایش یا کاهش فرکانس و دامنه پاسخ دهد یا وقفه موقت را نشان دهد که به عنوان بازنشانی فاز اشاره شدهاست. علاوه بر این، فعالیتهای خارجی ممکن است در همه فعالیتهای در حال انجام فعالیت نداشته باشد و منجر به پاسخ اضافی شود.
 دامنه فعالیت نوسانی مداوم بین t1 و t2 افزایش یافتهاست.
دامنه فعالیت نوسانی مداوم بین t1 و t2 افزایش یافتهاست. فرکانس فعالیت نوسانی مداوم بین t1 و t2 افزایش یافتهاست.
فرکانس فعالیت نوسانی مداوم بین t1 و t2 افزایش یافتهاست. فعالیت به صورت خطی به فعالیتهای نوسان جاری بین t1 و t2 اضافه میشود.
فعالیت به صورت خطی به فعالیتهای نوسان جاری بین t1 و t2 اضافه میشود. فاز فعالیت نوسان جاری در t1 ریست میشود.
فاز فعالیت نوسان جاری در t1 ریست میشود.
فعالیت فعلی
فعالیت خود به خودی فعالیت مغزی است در غیاب یک کار صریح، مانند ورودی حسی یا خروجی موتور، و از این رو نیز به عنوان فعالیت حالت استراحت اشاره دارد. این مخالفت با فعالیت القا شدهاست، یعنی فعالیت مغزی که توسط محرکهای حسی یا پاسخهای حرکتی به وجود میآید. فعالیت مغز در حال انجام اصطلاح در استفاده های کامپیوتری و magnetoencephalography برای آن دسته از اجزا سیگنال است که با پردازش یک همراه نیست محرک یا از وقوع حوادث خاص دیگر، مانند در حال حرکت بخشی از بدن، حوادث یعنی که فرم نیست پتانسیلهای برانگیخته / برانگیخته زمینهها یا فعالیت القا شدهاست. فعالیت خود به خودی معمولاً به عنوان سر و صدایی در نظر گرفته میشود اگر کسی علاقهمند به پردازش محرک باشد؛ با این حال، فعالیت خود به خودی در نظر گرفته میشود که نقش مهمی در رشد مغز، مانند تشکیل شبکه و synaptogenesis. فعالیت خودبخودی ممکن است در مورد وضعیت ذهنی فعلی فرد (مانند بیداری، هشیاری) و اغلب در تحقیقات خواب استفاده شود. برخی از انواع فعالیتهای نوسان مانند امواج آلفا بخشی از فعالیت خودبخودی هستند. تجزیه و تحلیل آماری از نوسانات قدرت فعالیت آلفا نشان میدهد توزیع دوگانه، به عنوان مثال حالت بالا و پایین دامنه، و از این رو نشان میدهد که فعالیت حالت استراحت نه تنها یک فرایند سر و صدا را منعکس می کند.[41] در مورد fMRI، نوسانات خود به خودی در سیگنال وابسته به سطح اکسیژن (BOLD) نشان دهنده الگوهای همبستگی است که با شبکههای حالت استراحت مرتبط هستند، مانند شبکه پیش فرض.[42] تکامل زمانی شبکههای حالت استراحتی با نوسانات فعالیت EEG نوسان در باند فرکانسهای مختلف مرتبط است.[43]
فعالیت مغز در حال انجام نیز ممکن است نقش مهمی در ادراک داشته باشد، زیرا ممکن است با فعالیت مرتبط با محرکهای ورودی ارتباط برقرار کند. در واقع، مطالعات EEG نشان میدهد که ادراک بصری وابسته به فاز و دامنه نوسانات کورتنی است. به عنوان مثال، دامنه و فاز فعالیت آلفا در لحظه تحریک بصری پیشبینی میکند که آیا یک محرک ضعیف با موضوع درک میشود.[44][45][46]
پاسخ فرکانس
در پاسخ به ورودی، یک گروه نورونی یا عصبی ممکن است فرکانسی را که در آن نوسان میکند، تغییر دهد، بنابراین نرخ سرعت تغییر میکند. اغلب میزان شلیک نورون به فعالیت خلاصه شده بستگی دارد. تغییرات فرکانس نیز معمولاً در ژنراتورهای الگو مرکزی دیده میشود و بهطور مستقیم با سرعت فعالیتهای حرکتی، مانند فرکانس گشت در راه رفتن، ارتباط دارد. با این حال، تغییرات در فرکانس نوسان نسبی بین مناطق مختلف مغز بسیار رایج نیست، زیرا فرکانس فعالیتهای نوسانی اغلب با تأخیر زمانی در ناحیه مغز مرتبط است.
تنظیم مجدد فاز
تنظیم مجدد فاز زمانی رخ میدهد که ورودی به یک گروه نورونی یا عصبی فاز نوسانات جاری را بازنشانی کند.[47] این در عصبهای تک سلولی بسیار رایج است که زمانبندی سنبله به ورودی عصبی تنظیم میشود (یک نورون ممکن است با تأخیر ثابت در پاسخ به ورودی دوره ای، که به عنوان قفل فاز[13] نامیده میشود، افزایش یابد) و همچنین ممکن است در گروههای عصبی رخ دهد فازهای نورونی آنها بهطور همزمان تنظیم میشوند. تنظیم مجدد فاز برای هماهنگ سازی نورونهای مختلف یا مناطق مختلف مغز اساسی است[12][29] چون زمان شمعها میتواند به فاز فعال شدن سایر نورونها تبدیل شود.
بازنشستگی فاز همچنین اجازه مطالعه فعالیت ناشی از تحریک شده را میدهد، اصطلاحی که در الکتروانسفالوگرافی و مغناطیس فالوگرافی برای پاسخ به فعالیت مغز استفاده میشود که بهطور مستقیم مرتبط با فعالیتهای مرتبط با محرک است. پتانسیلهای تحریک شده و پتانسیل مربوط به رویداد از طریق الکتروانسفالوگرام به وسیله محاسبه محرک محور به دست میآید، بهطور میانگین، محاسبات مختلف در زمانهای ثابت در اطراف ارائه یک محرک. به عنوان یک نتیجه، آن سیگنالهای اجزاء که در هر اندازهگیری یکسان هستند، حفظ میشوند و همهٔ دیگر، یعنی فعالیتهای در حال انجام یا خود به خودی، بهطور میانگین میباشد. به عبارت دیگر، پتانسیل مربوط به رویداد تنها نشان دهنده نوسان در فعالیت مغز است که به محرک یا رویداد فاز قفل شدهاست. فعالیتهای تحریک شده اغلب در نظر گرفته میشود که مستقل از فعالیت مغز در حال انجام است، اگر چه این یک بحث مداوم است.[48][49]
پاسخ دامنه
در کنار فعالیتهای تحریک شده، فعالیت عصبی مربوط به پردازش محرک ممکن است منجر به فعالیت القا شود. فعالیت القا شده به مدولاسیون در فعالیت مغزی مداوم ناشی از پردازش محرکها یا آمادهسازی حرکت میپردازد. از این رو، آنها منعکسکننده یک پاسخ غیرمستقیم در مقایسه با پاسخهای تحریک شدهاست. یک نوع مطالعاتی که به خوبی مورد مطالعه قرار گرفتهاست، تغییرات دامنه ای در فعالیت نوسان است. به عنوان مثال، فعالیت گاما اغلب در طول فعالیتهای ذهنی افزایش مییابد، مانند نمایش دادن شیء.[50] از آنجایی که پاسخهای القا شده ممکن است در مراحل مختلف در مراحل مختلف اندازهگیری شوند و بنابراین در طی میانگین، آنها میتوانند با استفاده از تجزیه و تحلیل فرکانس زمان انجام شوند. فعالیتهای القا شده بهطور کلی فعالیتهای نورونهای متعدد را نشان میدهد: تغییرات دامنه ای در فعالیتهای نوسانی بواسطه هماهنگ سازی فعالیتهای عصبی به وجود میآیند، بهطور مثال از طریق هماهنگ سازی سنسورهای سنبله یا نوسانات بالقوه غشاء نورونهای فردی. بنابراین افزایش فعالیتهای نوسان در اغلب موارد به عنوان هماهنگ سازی مربوط به رویداد اشاره میشود، در حالی که کاهش آنها به عنوان ناهنجاری مرتبط با رویداد اشاره میشود.[51]
مدولاسیون دامنهٔ نامتقارن
به تازگی پیشنهاد شدهاست که حتی اگر فازها در سراسر آزمایشها ناهماهنگ باشند، فعالیت القایی ممکن است هنوز هم باعث ایجاد پتانسیل مرتبط با رویداد شود ، زیرا نوسانات مغزی ممکن است متقارن باشند و بنابراین تعدیلات دامنه میتواند تغییرات پایه ای را که بهطور متوسط از بین نمیرود، را به وجود آورند.[52][53] این مدل نشان میدهد که پاسخهای مربوط به رویدادهای آهسته مانند فعالیت نامتقارن آلفا میتواند منجر به تعدیل دامنه نوسان مغناطیسی نامتقارن مانند عدم تقارن جریانهای درون سلولی شود که به سمت پایین حرکت میکنند.[54] بر اساس این فرض، عدم تقارن در جریان دندریتیک باعث ایجاد عدم تقارن در فعالیت نوسانگر شناساییی شده توسط EEG و MEG میشود، زیرا جریانهای دندریتیک در سلولهای هرمی بهطور کلی سیگنالهای EEG و MEG تولید میکنند که میتوانند در پوست سر اندازهگیری شوند.[55]
نوسانهای عصبی از منظر کدگذاری
در مبحث کدگذاری عصبی، فرضیه های کدگذاریای (یعنی روش های تفسیر کدهای فعالیت نورونی) مبتنی بر فعالیت های نوسانی نورونها پیشنهاد شدهاند. در این حوزه، نوسان های عصبی، نه ار بابت مکانیزم ایجاد این نوسانها، بلکه از منظر دریافت کننده ی سیگنال ها (کدگذاری های حاصل در سمت گیرنده) معنا پیدا میکنند. به عبارت دیگر، بررسی این پرسش است که از دید مخابراتی و نظریه اطلاعاتی، این سیگنالها (جنبه ی نوسانی آنها) چگونه در تفسیر و کد گذاری سیگنال بکار میروند یا اهمیت پیدا میکنند.
به عنوان مثال، فاز شلیک یک نوع کدگذاری عصبی است که فرض میکند که تفسیر گیرنده، بر اساس کنار هم قراردادن نوسانهای عصبی و شلیکهای نورونی است.
کارکرد
هماهنگ سازی عصبی میتواند توسط محدودیتهای کاری مانند توجه انجام شود و تصور میشود نقش مهمی در ویژگی اتصال ،[56] ارتباطات عصبی،[5] و هماهنگی موتورداشته باشد.[7] نوسانهای عصبی در دهه ۱۹۹۰ به موضوع داغ در علوم اعصاب تبدیل شد، زمانی که مطالعات سیستم دیداری مغز توسطگری خوانگر و دیگران انجام میشد از فرضیه اتصال عصبی حمایت میکرد.[57] با توجه به این ایده، نوسانات همزمان در گروههای عصبی، نورونها را به یکدیگر متصل میکنند که ویژگیهای مختلف یک شی را نشان میدهند. به عنوان مثال، هنگامی که یک فرد به یک درخت نگاه میکند، نورونهای قشر بصری نماینده تنه درخت و نورونهایی که شاخههای یک درخت مشابه را نشان میدهند، همگام سازی میشوند تا یک نمایش واحد درخت ایجاد شود. این پدیده بهتر است در پتانسیلهای محلی دیده شود که منعکسکننده فعالیت همزمان در گروههای محلی نورونها است، اما همچنین در ضبط EEG و MEG نشان داده شدهاست که شواهد افزایش یافته برای یک رابطه نزدیک بین فعالیتهای نوسانی همزمان و انواع توابع شناختی.[56]
ضربان قلب
سلولها در گره سینوسی-دهلیزی، واقع در دهلیز راست قلب، خود به خود دپولاریزه میشوند در حدود ۱۰۰ بار در دقیقه. گرچه تمام سلولهای قلب قادر به تولید پتانسیلهای عمل هستند که موجب انقباض قلب میشوند، گره SA بهطور معمول آن را آغاز میکند، به این دلیل که باعث میشود پتانسیل عملها کمی سریعتر از مناطق دیگر باشند. از این رو، این سلولها ریتم طبیعی قلب را تولید میکنند و آنها بهطور مستقیم میزان ضربان قلب را کنترل میکنند. در غیاب کنترل عصبی و هورمونی بیرونی، سلولهای گره SA به صورت ریتمیک تخلیه میشوند. گره SA به وسیله دستگاه عصبی خودگردان کنترل میشوند، که زیاد و کم شدن فرکانس شلیک خود به خودی سلولهای ضربان ساز را تنظیم میکند.
ژنراتور الگو مرکزی
شلیک همزمان نورونها اساس دستورات حرکتی دوره ای برای حرکات ریتمیک را تشکیل میدهند. این خروجیهای ریتمیک توسط گروهی از نورونهای تعاملی ایجاد میشوند که یک شبکه را تشکیل میدهند که به عنوان یک ژنراتور الگوی مرکزی نامیده میشود. ژنراتور الگوی مرکزی مدارهای نورونی است که وقتی فعال میشوند میتوانند الگوهای حرکتی ریتمیک را در غیاب ورودیهای حسی که اطلاعات مربوط به زمانبندی خاصی را حمل میکنند، تولید کند. نمونههایی از آن راه رفتن، تنفس و شنا است.[58] اکثر شواهد برای ژنراتورهای الگوی مرکزی از حیوانات پایینتر مانند مکنده ماهی میآیند،اما شواهدی نیز وجود دارد مبنی بر اینکه ژنراتور الگوی مرکزی در نخاع انسان است.[59][60]
پردازش اطلاعات
عصبب بهطور کلی مبنای انتقال اطلاعات در مغز است. برای چنین انتقال، اطلاعات باید در یک الگوی Spiking کد گذاری شود. انواع مختلف برنامهنویسی، مانند برنامهنویسی سرعت و برنامهنویسی زمانی ارائه شدهاست. نوسانهای عصبی میتوانند پنجرههای دوره ای را ایجاد کنند که در آن اسپایکهای ورودی تأثیر بیشتری بر نورون دارند، بنابراین مکانیزم برای رمزگشایی کدهای زمانی فراهم میشود.[61]
ادراک
هماهنگ سازی شلیک نورونها ممکن است به عنوان وسیله ای برای دستهبندی نورونهای جدا شده فضایی که به محرکهای مشابه پاسخ دهند، به منظور اتصال این پاسخها برای پردازش بیشتر مشترک، یعنی بهرهبرداری از هماهنگی زمانی برای رونویسی روابط باشد. ابتدا[62] اما فرمولهای تئوریک ترکیبی از فرضیه اتصال به هماهنگی ارائه شدهاست، اما بعد از آن شواهد تجربی گستردهای از نقش بالقوه همخونی به عنوان یک کد ارتباطی پشتیبانی شدهاست.[63]
نقش کاربردی فعالیتهای نوسان همزمان در مغز عمدتاً در آزمایشهایی که بر روی بچه گربههای بیدار انجام شده و با چندین الکترود انجام شده در قشر بینایی انجام شده بود، تأیید شد. این آزمایشها نشان میدهد که گروههای نورونهای جدا شده فضایی در فعالیتهای نوسان همزمان همزمان فعال شده توسط محرکهای بصری. فرکانس این نوسانها در محدوده ۴۰ است هرتز و از فعال سازی دوره ای ناشی از گرید متفاوت است، که نشان میدهد که نوسانات و هماهنگ سازی آنها به دلیل تعاملات عصبی داخلی بودهاست.[63] یافتههای مشابه به صورت موازی توسط گروه Eckhorn نشان داده شدهاست، و شواهد بیشتری را برای نقش کاربردی هماهنگ سازی عصبی در اتصال به ویژگی ارائه میکنند.[64] از آن به بعد، مطالعات متعدد این یافتهها را تکرار کرده و آنها را به روشهای مختلف مانند EEG گسترش داده و شواهد گستردهای از نقش کاربردی نوسانات گاما را در ادراک بصری ارائه میدهد.
ژیل لورنت و همکارانش نشان دادند که هماهنگ سازی نوسانگر نقش مهمی در ادراک بوی دارد. درک بویهای مختلف منجر به ایجاد زیر مجموعههای مختلف نورونهای شلیک در مجموعههای مختلف چرخه نوسان میشود.[65] این نوسانات را میتوان با پیکروتوکسین مسدودکننده GABA مختل کرد[66] و اختلال در هماهنگ سازی نوسانات منجر به اختلال در رفتارهای شیمیائی شبیهسازی شده در زنبورها میشود[67] و همچنین واکنشهای مشابه تر در برابر بوهای درون سلولهای بتا لوب پایین دست.[68] پیگیریهای اخیر این کار نشان دادهاست که نوسانات پنجرههای ادغام دوره ای برای سلولهای کنیون در بدن قارچ حشرات ایجاد میکنند، به طوری که شمعهای ورودی از لبه انتنال در فعال شدن سلولهای کنیون تنها در مراحل خاص چرخه نوسان مؤثر هستند.[61]
به نظر میرسد نوسانهای عصبی نیز به معنای زمان[69] و در درک سوماوزنسوری باشند.[70] با این حال، یافتههای اخیر بر خلاف یک کارکرد ساعت مانند نوسانات گاما قشر استدلال میکنند.[71]
حافظه
نوسان عصبی، به ویژه فعالیت تتا، بهطور گستردهای با عملکرد حافظه ارتباط دارد. ریتم تتا در حین یادگیری و بازیابی حافظه در هیپوکمپ و قشر نفوذی مغز بسیار قوی است و اعتقاد بر این است که ایجاد پتانسیل عمل طولانی مکانیسم بالقوه سلولی برای یادگیری و حافظه است. یادگیری و حافظه به اتصال بین موجهای تتا و گاما بستگی دارد خصوصاً حافظه رویدادی .[72][73] هماهنگی خوب بین نورونها باعث بهبود حافظه میشود.[74]
خواب و آگاهی
خواب یک حالت طبیعی است که در آن آگاهی و خود اگاهی کم است که به دورههای حرکت سریع چشم (REM) و حرکت حرکت چشم غیر سریع (NREM) تقسیم میشود. مراحل خواب با ویژگی طیفی EEG مشخص میشوند: به عنوان مثال مرحله N1 به انتقال مغز از امواج آلفا (معمول در حالت بیداری) به امواج تتا اشاره میکند، در حالی که مرحله N3 (خواب عمیق یا آهسته) با حضور امواج دلتا. نظم معمول مراحل خواب N1 → N2 → N3 → N2 → REM است.
توسعه
نوسانات عصبی ممکن است در توسعه عصبی نقش داشته باشد. به عنوان مثال، امواج شبکیه ای دارای ویژگیهایی هستند که اتصال زود هنگام مدار و سیناپسها را بین سلولهای شبکیه تعریف میکنند.[75]
آسیبشناسی
انواع خاصی از نوسانهای عصبی نیز ممکن است در شرایط پاتولوژیک، مانند بیماری پارکینسون یا صرع ظاهر شوند. این نوسانات پاتولوژیک اغلب به دلیل نوسانهای غیرطبیعی نورونها است. به عنوان مثال، یکی از انواع شناخته شدهترین نوع نوسانات نوسان اسپایک است که بهطور معمول در صرع عمومی رخ میدهد.
لرزش
لرزش یک حرکت غیرمستقیم، تا حدودی ریتمیک، انقباض عضلانی و آرامش است که شامل حرکات حرکتی یک یا چند قسمت بدن است. و میتواند بر روی دستها، چشمها، صورت، سر، تارهای صوتی و پاها تأثیر بگذارد. بیشتر لرزشها در دست رخ میدهد. در برخی افراد، لرزش علائم دیگری از اختلالات عصبی است. انواع مختلف لرزش شناسایی شدهاند مانند ترمور ضروری یا لرزش پارکینسونی. استدلال میشود که لرزشها احتمالاً مولتی فاکتوریل هستند و از طریق نوسانهای عصبی در سیستمهای عصبی مرکزی و مکانیسمهای محیطی مانند رزونانس حلقه رفلکس پدید می آیند.[76]
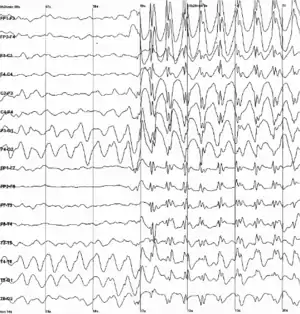
صرع
صرع یک اختلال مزمن عصبی است که به عنوان تشنج شناخته میشود. این تشنج نشانههای گذرا یا علائم فعالیت غیرطبیعی، بیش از حد نرونها در مغز است.[77]
کاربردها
نقطه پایان بالینی
نوسانهای عصبی به چندین دارو که بر فعالیت مغز تأثیر میگذارند حساس هستند. بنابراین نشانگر های زیستی مبتنی بر نوسان عصبی به عنوان نقطه پایانی در مطالعات بالینی و در مقادیر کمی در مطالعات قبل از بالینی ظهور میکنند. این نشانگرهای زیست شناختی اغلب به نام "بیومارکرهای EEG" یا "بیومارکرهای نورولوژیکی" نامگذاری شدهاند و با استفاده از الکتروانسفالوگرافی کمی (qEEG) اندازهگیری میشوند.
رابط مغز و رایانه(BCI)
نوسان عصبی به عنوان یک سیگنال کنترل در واسط مغز و رایانه (BCI) میباشد .[78] برای مثال، رابط کاربری BCI غیر تهاجمی را میتوان با قرار دادن الکترود روی پوست سر و سپس اندازهگیری سیگنالهای الکتریکی ضعیف راه اندازی کرد. اگرچه فعالیتهای نورونی فردی را از طریق BCI غیر تهاجمی نمیتوان به خوبی اندارهگیری کرد، زیرا جمجمه خم میشود و سیگنالهای الکترومغناطیسی را مختل میکند، اما فعالیتهای نوسانی هنوز هم قابل اعتماد است.
بهطور خاص، برخی از اشکال BCI به کاربران امکان کنترل دستگاه را با اندازهگیری دامنه فعالیت نوسان در باند فرکانس خاص میدهد.
مثال ها
لیستی غیرمستقیم از انواع فعالیتهای نوسان در سیستم عصبی مرکزی:
جستارهای وابسته
- سایبرنتیک
- واسط مغز و رایانه
- کدگذاری عصبی
- فاز شلیک یک نوع کدگذاری عصبی بر اساس تقابل بین نوسان های عصبی و شلیکهای نورونی
منابع
- Llinas, R. R. (2014). "Intrinsic electrical properties of mammalian neurons and CNS function: a historical perspective". Front Cell Neurosci. 8: 320. doi:10.3389/fncel.2014.00320. PMC 4219458. PMID 25408634.
- "Caton, Richard - The electric currents of the brain". echo.mpiwg-berlin.mpg.de. Retrieved 2018-12-21.
- Coenen, Anton; Edward Fine; Oksana Zayachkivska (2014). "Adolf Beck: A Forgotten Pioneer In Electroencephalography". Journal of the History of the Neurosciences. 23 (3): 276–286. doi:10.1080/0964704x.2013.867600. PMID 24735457.
- Pravdich-Neminsky, VV. (1913). "Ein Versuch der Registrierung der elektrischen Gehirnerscheinungen". Zentralblatt für Physiologie. 27: 951–60.
- Fries P (2005). "A mechanism for cognitive dynamics: neuronal communication through neuronal coherence". TICS. 9 (10): 474–480. doi:10.1016/j.tics.2005.08.011. PMID 16150631.
- Fell J, Axmacher N (2011). "The role of phase synchronization in memory processes". Nature Reviews Neuroscience. 12 (2): 105–118. doi:10.1038/nrn2979. PMID 21248789.
- Schnitzler A, Gross J (2005). "Normal and pathological oscillatory communication in the brain". Nature Reviews Neuroscience. 6 (4): 285–296. doi:10.1038/nrn1650. PMID 15803160.
- Foster, JJ; et al. (July 2017). "Alpha-Band Oscillations Enable Spatially and Temporally Resolved Tracking of Covert Spatial Attention". Psychological Science. 28 (7): 929–941. doi:10.1177/0956797617699167. PMC 5675530. PMID 28537480.
- Berger H, Gray CM (1929). "Uber das Elektroenkephalogramm des Menschen". Arch Psychiat Nervenkr. 87: 527–570. doi:10.1007/BF01797193.
- Dement W, Kleitman N (1957). "Cyclic variations in EEG during sleep and their relation to eye movements, body motility and dreaming". Electroencephalogr Clin Neurophysiol. 9 (4): 673–90. doi:10.1016/0013-4694(57)90088-3. PMID 13480240.
- Engel AK, Singer W (2001). "Temporal binding and the neural correlates of sensory awareness". Trends in Cognitive Sciences. 5 (1): 16–25. doi:10.1016/S1364-6613(00)01568-0. PMID 11164732.
- Varela F, Lachaux JP, Rodriguez E, Martinerie J (2001). "The brainweb: phase synchronization and large-scale integration". Nature Reviews Neuroscience. 2 (4): 229–239. doi:10.1038/35067550. PMID 11283746.
- Izhikevich EM (2007). Dynamical systems in neuroscience. Cambridge, Massachusetts: The MIT Press.
- Llinas R, Yarom Y (1986). "Oscillatory properties of guinea-pig inferior olivary neurones and their pharmacological modulation: an in vitro study". J Physiol. 376: 163–182. PMC 1182792. PMID 3795074.
- Mureșan RC, Jurjuț OF, Moca VV, Singer W, Nikolić D (2008). "The Oscillation Score: An Efficient Method for Estimating Oscillation Strength in Neuronal Activity". Journal of Neurophysiology. 99 (3): 1333–1353. doi:10.1152/jn.00772.2007. PMID 18160427.
- Burrow T (1943). "The neurodynamics of behavior. A phylobiological foreword". Philosophy of Science. 10 (4): 271–288. doi:10.1086/286819.
- Vansteensel, Mariska J.; Pels, Elmar G.M.; Bleichner, Martin G.; Branco, Mariana P.; Denison, Timothy; Freudenburg, Zachary V.; Gosselaar, Peter; Leinders, Sacha; Ottens, Thomas H. (2016). "Fully Implanted Brain–Computer Interface in a Locked-In Patient with ALS". New England Journal of Medicine. 375 (21): 2060–2066. doi:10.1056/NEJMoa1608085.
- Haken H (1996). Principles of brain functioning. Springer. ISBN 978-3-540-58967-9.
- Wang XJ (2010). "Neurophysiological and computational principles of cortical rhythms in cognition". Physiol Rev. 90 (3): 1195–1268. doi:10.1152/physrev.00035.2008. PMC 2923921. PMID 20664082.
- Electric fields of the brain: The neurophysics of EEG. Oxford University Press. 1981.
- Cardin JA, Carlen M, Meletis K, Knoblich, U, Zhang F, Deisseroth K, Tsai LH, Moore CI (2009). "Driving fast-spiking cells induces gamma rhythm and controls sensory responses". Nature. 459 (7247): 663–U63. Bibcode:2009Natur.459..663C. doi:10.1038/nature08002. PMC 3655711. PMID 19396156.
- Llinás R, Ribary U, Contreras D, Pedroarena C (November 1998). "The neuronal basis for consciousness". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 353 (1377): 1841–9. doi:10.1098/rstb.1998.0336. PMC 1692417. PMID 9854256.
- Bollimunta A, Mo J, Schroeder CE, Ding M (March 2011). "Neuronal mechanisms and attentional modulation of corticothalamic α oscillations". The Journal of Neuroscience. 31 (13): 4935–43. doi:10.1523/JNEUROSCI.5580-10.2011. PMC 3505610. PMID 21451032.
- Suffczynski P, Kalitzin S, Pfurtscheller G, Lopes da Silva FH (December 2001). "Computational model of thalamo-cortical networks: dynamical control of alpha rhythms in relation to focal attention". International Journal of Psychophysiology. 43 (1): 25–40. doi:10.1016/S0167-8760(01)00177-5. PMID 11742683.
- Cabral J, Luckhoo H, Woolrich M, Joensson M, Mohseni H, Baker A, Kringelbach ML, Deco G, et al. (April 2014). "Exploring mechanisms of spontaneous functional connectivity in MEG: how delayed network interactions lead to structured amplitude envelopes of band-pass filtered oscillations". NeuroImage. 90: 423–35. doi:10.1016/j.neuroimage.2013.11.047. PMID 24321555.
- Llinas RR (1988). "The Intrinsic electrophysiological properties of mammalian neurons: A new insight into CNS function". Science. 242 (4886): 1654–1664. Bibcode:1988Sci...242.1654L. doi:10.1126/science.3059497. PMID 3059497.
- Llinas RR, Grace AA, Yarom Y (1991). "In vitro neurons in mammalian cortical layer 4 exhibit intrinsic oscillatory activity in the 10- to 50-Hz frequency range". Proc. Natl. Acad. Sci. U.S.A. 88 (3): 897–901. Bibcode:1991PNAS...88..897L. doi:10.1073/pnas.88.3.897. PMC 50921. PMID 1992481.
- Zeitler M, Daffertshofer A, Gielen CC (2009). "Asymmetry in pulse-coupled oscillators with delay". Phys. Rev. E. 79 (6). Bibcode:2009PhRvE..79f5203Z. doi:10.1103/PhysRevE.79.065203. PMID 19658549.
- Synchronization: a universal concept in nonlinear sciences. Cambridge University Press. 2001. ISBN 978-0-521-53352-2.
- آندریا بروولی، استیون ال. بسللر و همکارانش، 2004
- Muthukumaraswamy SD, Edden RA, Jones DK, Swettenham JB, Singh KD (2009). "Resting GABA concentration predicts peak gamma frequency and fMRI amplitude in response to visual stimulation in humans". Proc. Natl. Acad. Sci. U.S.A. 106 (20): 8356–8361. Bibcode:2009PNAS..106.8356M. doi:10.1073/pnas.0900728106. PMC 2688873. PMID 19416820.
- Moruzzi G, Magoun HW (1949). "Brain stem reticular formation and activation of the EEG". Electroencephalogr Clin Neurophysiol. 1 (4): 455–473. doi:10.1016/0013-4694(49)90219-9. PMID 18421835.
- Buzsaki G, Draguhn A (2004). "Neuronal oscillations in cortical networks". Science. 304 (5679): 1926–1929. Bibcode:2004Sci...304.1926B. doi:10.1126/science.1099745. PMID 15218136.
- Whittington MA, Traub RD, Kopell N, Ermentrout B, Buhl EH (2000). "Inhibition-based rhythms: experimental and mathematical observations on network dynamics". Int J Psychophysiol. 38 (3): 315–336. CiteSeerX 10.1.1.16.6410. doi:10.1016/S0167-8760(00)00173-2. PMID 11102670.
- Wendling F, Bellanger JJ, Bartolomei F, Chauvel P (2000). "Relevance of nonlinear lumped-parameter models in the analysis of depth-EEG epileptic signals". Biol Cybern. 83 (4): 367–378. doi:10.1007/s004220000160. PMID 11039701.
- Bressloff PC, Cowan JD (2003) شکلگیری الگوی خودبخودی در قشر اولیه بصری. در: J Hogan, AR Krauskopf, M di Bernardo, RE Wilson (Eds)، دینامیک غیر خطی و هرج و مرج: کجا از اینجا برویم؟
- Kuramoto Y (1984). Chemical Oscillations, Waves, and Turbulence. Dover Publications.
- Ermentrout B (1994). "An introduction to neural oscillators". In F Ventriglia. Neural Modeling and Neural Networks. pp. 79–110.
- Breakspear M, Heitmann S, Daffertshofer A (2010). "Generative models of cortical oscillations: Neurobiological implications of the Kuramoto model". Front Hum Neurosci. 4. doi:10.3389/fnhum.2010.00190. PMC 2995481. PMID 21151358.
- Cabral J, Hugues E, Sporns O, Deco G (2011). "Role of local network oscillations in resting-state functional connectivity". NeuroImage. 57 (1): 130–9. doi:10.1016/j.neuroimage.2011.04.010. PMID 21511044.
- Freyer F, Aquino K, Robinson PA, Ritter P, Breakspear M (2009). "Bistability and non-Gaussian fluctuations in spontaneous cortical activity". J Neurosci. 29 (26): 8512–8524. doi:10.1523/JNEUROSCI.0754-09.2009. PMID 19571142.
- Fox MD, Raichle ME (2007). "Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging". Nat Rev Neurosci. 8 (9): 700–711. doi:10.1038/nrn2201. PMID 17704812.
- Laufs H, Kraków K, Sterzer P, Eger E, Beyerle A, Salek-Haddadi A, Kleinschmidt A (2003). "Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging". PNAS. 100 (19): 11053–11058. Bibcode:2003PNAS..10011053L. doi:10.1073/pnas.1831638100. PMC 196925. PMID 12958209.
- Mathewson KE, Gratton G, Fabiani M, Beck DM, Ro T (2009). "To see or not to see: Prestimulus α phase predicts visual awareness". J Neurosci. 29 (9): 2725–32. doi:10.1523/JNEUROSCI.3963-08.2009. PMC 2724892. PMID 19261866.
- Busch NA, Dubois J, VanRullen R (2009). "The phase of ongoing EEG oscillations predicts visual perception". J Neurosci. 29 (24): 7869–76. doi:10.1523/jneurosci.0113-09.2009. PMID 19535598.
- van Dijk H, Schoffelen JM, Oostenveld R, Jensen O (2008). "Prestimulus oscillatory activity in the alpha band predicts visual discrimination ability". J Neurosci. 28 (8): 1816–1823. doi:10.1523/jneurosci.1853-07.2008. PMID 18287498.
- Tass PA (2007). Phase resetting in medicine and biology: stochastic modelling and data analysis. Berlin Heidelberg: Springer-Verlag. ISBN 978-3-540-65697-5.
- Makeig S, Westerfield M, Jung TP, Enghoff S, Townsend J, Courchesne E, Sejnowski TJ (2002). "Dynamic brain sources of visual evoked responses". Science. 295 (5555): 690–694. Bibcode:2002Sci...295..690M. doi:10.1126/science.1066168. PMID 11809976.
- Mäkinen V, Tiitinen H, May P (2005). "Auditory event-related responses are generated independently of ongoing brain activity". NeuroImage. 24 (4): 961–968. doi:10.1016/j.neuroimage.2004.10.020. PMID 15670673.
- Tallon-Baudry C, Bertrand O (1999). "Oscillatory gamma activity in humans and its role in object representation". Trends Cogn Sci. 3 (4): 151–162. doi:10.1016/S1364-6613(99)01299-1. PMID 10322469.
- Pfurtscheller G; da Silva FHL (1999). "Event-related EEG/MEG synchronization and desynchronization: basic principles". Clin Neurophysiol. 110 (11): 1842–1857. doi:10.1016/S1388-2457(99)00141-8. PMID 10576479.
- Nikulin VV, Linkenkaer-Hansen K, Nolte G, Lemm S, Muller KR, Ilmoniemi RJ, Curio G (2007). "A novel mechanism for evoked responses in the human brain". Eur J Neurosci. 25 (10): 3146–3154. doi:10.1111/j.1460-9568.2007.05553.x. PMID 17561828.
- Mazaheri A, Jensen O (2008). "Asymmetric amplitude modulations of brain oscillations generate slow evoked responses". J Neurosci. 28 (31): 7781–7787. doi:10.1523/JNEUROSCI.1631-08.2008. PMID 18667610.
- Mazaheri A, Jensen O (2008). "Rhythmic pulsing: linking ongoing brain activity with evoked responses". Front Hum Neurosci. 4: 117.
- Hamalainen M, Hari R, Ilmoniemi RJ, Knuutila J, Lounasmaa OV (1993). "Magnetoencephalography - Theory, instrumentation, and applications to noninvasive studies of the working human brain". Rev Mod Phys. 65 (2): 413–497. Bibcode:1993RvMP...65..413H. doi:10.1103/RevModPhys.65.413.
- Singer W (1993). "Synchronization of cortical activity and its putative role in information processing and learning". Annu Rev Physiol. 55: 349–374. doi:10.1146/annurev.ph.55.030193.002025. PMID 8466179.
- Singer W, Gray CM (1995). "Visual feature integration and the temporal correlation hypothesis". Annu Rev Neurosci. 18: 555–586. CiteSeerX 10.1.1.308.6735. doi:10.1146/annurev.ne.18.030195.003011. PMID 7605074.
- Marder E, Bucher D (2001). "Central pattern generators and the control of rhythmic movements". Curr Biol. 11 (23): R986–R996. doi:10.1016/S0960-9822(01)00581-4. PMID 11728329.
- Dimitrijevic MR, Gerasimenko Y, Pinter MM (1998). "Evidence for a spinal central pattern generator in humans". Annals of the New York Academy of Sciences. 860 (1): 360–376. Bibcode:1998NYASA.860..360D. doi:10.1111/j.1749-6632.1998.tb09062.x. PMID 9928325.
- Danner SM, Hofstoetter US, Freundl B, Binder H, Mayr W, Rattay F, Minassian K (March 2015). "Human spinal locomotor control is based on flexibly organized burst generators". Brain. 138 (Pt 3): 577–88. doi:10.1093/brain/awu372. PMC 4408427. PMID 25582580.
- Gupta N, Singh SS, Stopfer M (December 2016). "Oscillatory integration windows in neurons". Nature Communications. 7: 13808. Bibcode:2016NatCo...713808G. doi:10.1038/ncomms13808. PMC 5171764. PMID 27976720.
- Milner PM (1974). "A model for visual shape recognition". Psychol. Rev. 81 (6): 521–535. doi:10.1037/h0037149. PMID 4445414.
- Gray CM, König P, Engel AK, Singer W (1989). "Oscillatory responses in cat visual cortex exhibit inter-columnar synchronization which reflects global stimulus properties". Nature. 338 (6213): 334–337. Bibcode:1989Natur.338..334G. doi:10.1038/338334a0. PMID 2922061.
- Eckhorn R, Bauer R, Jordan W, Brosch M, Kruse W, Munk M, Reitboeck HJ (1988). "Coherent oscillations: A mechanism of feature linking in the visual cortex? Multiple electrode and correlation analyses in the cat". Biol Cybern. 60 (2): 121–130. doi:10.1007/BF00202899. PMID 3228555.
- Wehr M, Laurent G (1996). "Odour encoding by temporal sequences of firing in oscillating neural assemblies". Nature. 384 (6605): 162–166. Bibcode:1996Natur.384..162W. doi:10.1038/384162a0. PMID 8906790.
- MacLeod K, Laurent G (1996). "Distinct mechanisms for synchronization and temporal patterning of odor-encoding neural assemblies". Science. 274 (5289): 976–979. Bibcode:1996Sci...274..976M. doi:10.1126/science.274.5289.976. PMID 8875938.
- Stopfer M, Bhagavan S, Smith BH, Laurent G (1997). "Impaired odour discrimination on desynchronization of odour-encoding neural assemblies". Nature. 390 (6655): 70–74. Bibcode:1997Natur.390...70S. doi:10.1038/36335. PMID 9363891.
- MacLeod K, Bäcker A, Laurent G (1998). "Who reads temporal information contained across synchronized and oscillatory spike trains?". Nature. 395 (6703): 693–698. Bibcode:1998Natur.395..693M. doi:10.1038/27201. PMID 9790189.
- Buhusi CV, Meck WH (2005). "What makes us tick? Functional and neural mechanisms of interval timing". Nature Reviews Neuroscience. 6 (10): 755–65. doi:10.1038/nrn1764. PMID 16163383.
- Temporal and spatial coding in the rat vibrissal system. Prog Brain Res. Progress in Brain Research. 130. 2001. pp. 75–87. doi:10.1016/S0079-6123(01)30007-9. ISBN 978-0-444-50110-3. PMID 11480290.
- Burns SP, Xing D, Shapley RM (2011). "Is gamma-band activity in the local field potential of V1 cortex a "clock" or filtered noise?". J Neurosci. 31 (26): 9658–9664. doi:10.1523/jneurosci.0660-11.2011. PMC 3518456. PMID 21715631.
- Buszaki G (2006). Rhythms of the brain. Oxford University Press.
- Nyhus E, Curran T (June 2010). "Functional role of gamma and theta oscillations in episodic memory". Neuroscience and Biobehavioral Reviews. 34 (7): 1023–35. doi:10.1016/j.neubiorev.2009.12.014. PMC 2856712. PMID 20060015.
- Rutishauser U, Ross IB, Mamelak AN, Schuman EM (April 2010). "Human memory strength is predicted by theta-frequency phase-locking of single neurons" (PDF). Nature. 464 (7290): 903–7. Bibcode:2010Natur.464..903R. doi:10.1038/nature08860. PMID 20336071.
- Feller, Marla B (2009-07-06). "Retinal waves are likely to instruct the formation of eye-specific retinogeniculate projections". Neural Development. 4: 24. doi:10.1186/1749-8104-4-24. ISSN 1749-8104. PMC 2706239. PMID 19580682.
- McAuley JH, Marsden CD (2000). "Physiological and pathological tremors and rhythmic central motor control". Brain. 123 (8): 1545–1567. doi:10.1093/brain/123.8.1545. PMID 10908186.
- V. Shusterman و WC تروی. از ابتدایی تا فعالیت epileptiform: مسیری برای ریتمیک همزمان در شبکههای عصبی در مقیاس بزرگ. Phys Rev E Stat Nonlin Soft ماده Phys. 2008؛ 77 (6 Pt 1): 061911
- Birbaumer, Neils (2006). "Breaking the silence: Brain-computer interfaces (BCI) for communication and motor control". Psychophysiology. 43 (6): 517–32. doi:10.1111/j.1469-8986.2006.00456.x. PMID 17076808.
برای مطالعهٔ بیشتر
- Buzsáki, György (2006). Rhythms of the Brain. Oxford University Press. ISBN 978-0-19-530106-9.
- Freeman, Walter (1975). Mass Action in the Nervous System. Academic Press. ISBN 978-0-12-412047-1. https://web.archive.org/web/20150705004813/http://sulcus.berkeley.edu/MANSWWW/MANSWWW.html