مگنتوانسفالوگرافی
مگنتوانسفالوگرافی (به انگلیسی:Magnetoencephalography)(مخفف:MEG) یک تکنیک تصویربرداری عصبی کارکردی برای نقشهبرداری فعالیتهای مغز با ثبت میدانهای مغناطیسی تولید شده توسط جریانهای الکتریکی، که بهطور طبیعی در مغز رخ میدهند، با استفاده از مغناطیس سنجهای بسیار حساس است. آرایههای SQUID (دستگاههای ابررسانا کوانتومی تداخلی) در حال حاضر رایجترین مغناطیس سنجها هستند، در حالی که مغناطیس سنج SERF (بدون تغییر اسپین تبادل) برای دستگاههای آینده مورد بررسی قرار گرفتهاند. برنامههای کاربردی MEG عبارتنداز: تحقیقات اولیه در فرایندهای شناختی و مغز، مناطق متأثر از آسیبشناسی قبل از جراحی، تعیین عملکرد قسمتهای مختلف مغز و نوروفیدبک. این میتواند در محیط بالینی برای پیدا کردن مکانهای ناهنجاری و همچنین در یک محیط آزمایشگاهی به سادگی برای اندازهگیری فعالیتهای مغز مورد استفاده قرار گیرد.
| مگنتوانسفالوگرافی | |
|---|---|
| تشخیص پزشکی | |
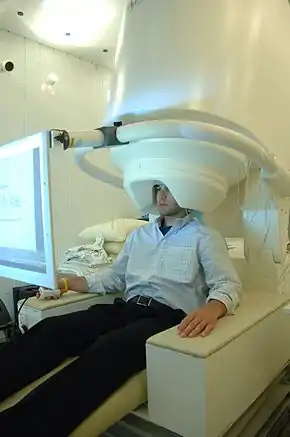 انجام مگنتوانسفالوگرافی روی یک مرد | |
| سرعنوانهای موضوعی پزشکی | D015225 |
تاریخچه
سیگنالهای MEG ابتدا توسط دیوید کوهن، فیزیکدان دانشگاهایلینوی در سال ۱۹۶۸، قبل از دسترسی به SQUID، با استفاده از سیم پیچ القایی مس به عنوان آشکارساز اندازهگیری شد. برای کاهش نویز زمینه مغناطیسی، اندازهگیریها در یک اتاق محافظت شده مغناطیسی انجام شد. آشکارساز کویل تقریباً به اندازه کافی حساس بود که منجر به MEG ضعیف و نویزی اندازهگیری شد ه شود که برای استفاده از آن دشوار بود. پس از آن، کوهن یک اتاق محافظتی بهتر را در MIT ساخت و یکی از اولین آشکارسازهای SQUID را که توسط جیمز زیمرمن، پژوهشگر شرکت فورد موتور طراحی شده بود، برای اندازهگیری سیگنالهای MEG استفاده کرد. این بار سیگنالها تقریباً به اندازه EEGها واضح بودند. این علاقه فیزیکدانانی که به دنبال استفاده از SQUID بودند را برانگیخت. پس از آن، انواع مختلفی از MEGهای خود به خودی و تحریک شده اندازهگیری شد.
در ابتدا، یک آشکارساز SQUID تنها برای اندازگیری متوالی میدان مغناطیسی در تعدادی از نقاط در اطراف سر نمونه مورد استفاده قرار گرفت. این کار دست و پاگیر بود و در دهه ۱۹۸۰ تولیدکنندگان MEG شروع به قراردادن چندین سنسور به صورت آرایههایی برای پوشش یک منطقه بزرگتر از سر کردند. آرایههای MEG در حال حاضر در یک ظرف با فضای خالی به شکل کلاه ایمنی قرار دارند که معمولاً شامل ۳۰۰ سنسور هستند که بیشترین قسمت را پوشش میدهند. به این ترتیب، MEGها از یک فرد یا بیمار میتوانند به سرعت و بهطور کارآمد جمعآوری شوند.
پیشرفتهای اخیر در تلاش برای افزایش قابلیت حمل اسکنر MEG با استفاده مغناطیس سنج(SERF) میباشند. مغناطیس سنجهای SERF نسبتاً کوچک هستند، زیرا آنها سیستم خنککننده بزرگی را برای کارکردن نیاز ندارند. در عین حال، آنها حساسیت مشابهی با SQUIDها دارند. در سال ۲۰۱۲، نشان داده شد که MEG میتواند با یک مغناطیس سنج اتمی (CSAM، نوع SERF) در مقیاس تراشه کار کند. اخیراً، در سال ۲۰۱۷، محققان یک نمونه اولیه تولید کردند که از مغناطیس سنج SERF نصب شده در کلاه ایمنی با قابلیت چاپ به صورت سه بعدی استفاده میکند.
اساس سیگنالهای MEG
جریانهای عصبی همگام موجب ایجاد میدان مغناطیسی ضعیف میشوند. میدانهای مغناطیسی مغز، اندازهای برابر با ۱۰ فمتو تسلا(fT) برای فعالیت کورتیکال و 103 fT برای ریتم آلفای انسان دارند، که بسیار کمتر از نویز مغناطیسی محیط در محیط شهری است که در حدود 108 fT یا ۰٫۱ μT است؛ بنابراین، مسئله مهم بیومغناطیس، ضعیف بودن سیگنال نسبت به حساسیت آشکارسازها و رقابت با نویزهای محیطی است. سیگنالهای EMG و EEG دراثر جریانهای سیال یونی در دندریت نورونها در هنگام انتقال سیناپسی حاصل میشوند. مطابق معادلات ماکسول، هر جریان الکتریکی یک میدان مغناطیسی تولید میکند و این میدان است که اندازهگیری میشود. جریانهای شبکه میتوانند به عنوان جریانهای دوقطبی در نظر گرفته شوند، به عنوان مثال جریان با موقعیت، جهتگیری و اندازه، اما بدون هیچ اندازه فضایی. با توجه به قانون دست راست، یک جریان دو قطبی موجب ایجاد میدان مغناطیسی میشود که در اطراف محور مؤلفه بردار آن قرار دارد.
برای تولید یک سیگنال که قابل تشخیص باشد، حدود ۵۰٬۰۰۰ نورون فعال مورد نیاز است. از آنجا که جریانهای دو قطبی باید دارای جهتگیری مشابهی باشند برای تولید میدانهای مغناطیسی که یکدیگر را تقویت میکنند، اغلب لایههای سلولهای هرمی که عمود بر سطح قشر کورتیکال قرار دارند، هستند که موجب ایجاد میدان مغناطیسی قابل اندازهگیری میشوند. دستهای از این نورونها که به صورت مماسی نسبت به سطح جمجمه متمرکز شدهاند، قسمتهای قابل اندازهگیری میدان مغناطیسی خود را خارج از سر قرار میدهند و این دستهها معمولاً در شیارهای مغز قرار دارند. محققان با آزمودن روشهای مختلف پردازش سیگنال در جستجوی روشهایی میباشند که سیگنال را از قسمتهای عمیق مغز شناسایی میکنند، اما در حال حاضر هیچ روش بالینی مفیدی در دسترس نیست. شایان ذکر است که پتانسیلهای عمل معمولاً یک میدان قابل مشاهده را تولید نمیکنند، عمدتاً به این دلیل که جریانهای مرتبط با پتانسیلهای عمل در جهت مخالف جریان مییابند و میدانهای مغناطیسی از بین میروند. با این حال، میدانهای عمل از اعصاب محیطی اندازهگیری شدهاند.
محافظت مغناطیسی
از آنجایی که سیگنالهای مغناطیسی ناشی از مغز در حدود چند فمتوتسلا میباشند، محافظت در برابر سیگنالهای مغناطیسی خارجی، از جمله میدان مغناطیسی زمین ضروری است. محافظت مغناطیسی مناسب را میتوان با ساخت اتاقهای ساخته شده از آلومینیوم و آلیاژهایی از نیکل برای کاهش نویز فرکانس بالا و فرکانس پایین به دست آورد.
اتاق محافظ مغناطیسی
اتاق محافظ مغناطیسی (به انگلیسی:Magnetically shielded room)، (مخفف:MSR) مدل اتاق محافظ مغناطیسی (MSR) شامل سه لایه اصلی تو در تو است. هر یک از این لایهها از یک لایه آلومینیوم خالص و یک لایه فرومغناطیس با نفوذ پذیری بالا، مشابه ترکیبات با مولیبدن پرمالوی (نوعی آلیاژ شامل آهن و نیکل) ساخته شدهاست. لایه فرومغناطیسی به صورت ورق ۱ میلیمتری عرضه میشود، در حالی که لایه درونی از چهار ورق که در تماس نزدیک با هم قرار دارند تشکیل شدهاست و دو لایه بیرونی هر کدام از سه ورقه تشکیل شدهاست. تداوم مغناطیسی توسط نوارها پوشش داده میشود. واشرهای عایق در مجموعه پیچها استفاده میشود تا اطمینان حاصل شود که هر لایه اصلی از لحاظ الکتریکی جدا شدهاست. این امر به کاهش تشعشعهای رادیویی کمک میکند، که عملکرد SQUID را کاهش میدهند. اتصال الکتریکی از آلومینیوم نیز توسط نوارهای آلومینیومی برقرار میشود تا محافظت در برابر جریان الکتریسیته ساکن را تأمین کند، که در فرکانسهای بیشتر از ۱ هرتز مهم است. اتصالات لایه داخلی اغلب با نقره یا طلا آبکاری میشود تا هدایت الکتریکی لایههای آلومینیومی را بهبود بخشد.
محلی سازی منبع
مشکل معکوس سازی
چالش ناشی از MEG تعیین مکان فعالیت الکتریکی درون مغز از میدان مغناطیسی ناشی ازآن در خارج از سراست. مشکلاتی مانند این که پارامترهای مدل (محل فعالیت) باید از دادههای اندازهگیری شده (سیگنال SQUID) برآورد شوند، به عنوان مشکل معکوس سازی (در مقایسه با مشکلات پیشین که پارامترهای مدل (مانند محل فعالیتها) شناخته شدهاست و دادهها (به عنوان مثال میدان در یک فاصله داده شده) باید تخمین زده شود) مشکل اصلی این است که معکوس سازی یک راهحل منحصر به فرد ندارد (یعنی پاسخهای زیادی به عنوان پاسخ صحیح وجود دارد) و مشکل تعریف بهترین راه حل، خود میتواند یک موضوع برای تحقیقی فشرده باشد. [۱۱] راهحل ممکن میتواند استفادهاز مدلهای که با دانش قبلی از فعالیت مغز مشتق شدهاست باشد.
مدلهای منبع میتوانند به صورت فرا معین یا فرو معین باشند. یک مدل فرا معین ممکن است از چند منبع نقطهای(" معادل دو قطبی") تشکیل شده باشد، که مکانهای آنها از دادهها برآورد میشوند. در مواردی که بسیاری از مناطق توزیع شده متفاوت ("راه حلهای منبع توزیع شده") فعال میشوند، ممکن است از مدلهای فرو معین استفاده شود: در این حالت تعداد زیادی جواب وجود دارد ولی محتملترین انتخاب میشود. الگوریتمهای محلی سازی از مدل داده شده منبع و سر برای پیدا کردن یک مکان احتمالی برای یک مرکز تولید این میدانها استفاده میکنند.
یک نوع الگوریتم محلیسازی برای مدلهای فرا معین با حداکثرسازی انتظارات عمل میکند: سیستم با یک حدس اولیه تنظیم میشود. یک لوپ آغاز شدهاست، که در آن یک مدل پیشین برای شبیهسازی میدانمغناطیسی استفاده میشود که ممکن است از حدس زدن فعلی حاصل شود. حدس زده شده، برای کاهش اختلاف بین میدان شبیهسازی شده و میدان اندازهگیری شده تعدیل میگردد. این روند تا زمان همگرایی تکرار میشود.
یکی دیگر از تکنیکهای رایج، شکلدهی پرتو است که در آن یک مدل نظری از میدان مغناطیسی تولید شده توسط یک جریان دو قطبی دادهشده به عنوان یک حالت اولیه همراه با دادههای مرتبه دوم تصادفی به صورت یک ماتریس کوواریانس برای محاسبه وزن خطی آرایه سنسور (beam former) از طریق فرمول معکوس بیکوس گیلبرت است. این همچنین به عنوان شکلدهی پرتو خطی محدود شده با کمترین اختلاف شناخته میشود (به انگلیسی: linearly constrained minimum variance) (مخفف:LCMV).
تا زمانی که مسئله مشکل معکوس سازی بدون محدودیت MEG بد رفتار است، نمیتوان بیش از حد مورد توجه قرار گیرد. اگر یک هدف این است که تراکم جریان در مغز انسان با یک رزولوشن ۵ میلیمتر را تخمین بزنیم، آن را به خوبی ثابت میکنیم که اکثریت قریب به اتفاق اطلاعات مورد نیاز برای انجام یک عمل معکوس کردن منحصر به فرد باید از اندازهگیری میدان مغناطیسی نباشد، بلکه از محدودیتهای استفاده شده در مشکل باشد. علاوه بر این، حتی زمانی که یک معکوس منحصر به فرد در حضور چنین محدودیت امکانپذیر است، این معکوس میتواند ناپایدار باشد. این نتیجهگیریها به راحتی از آثار منتشر شده حاصل میشود.
تصویربرداری منبع مغناطیسی
مکانهای منبع را میتوان با تصاویر تصویربرداری رزونانس مغناطیسی (MRI) ترکیب کرد تا تصاویر منبع مغناطیسی (MSI) ایجاد کنند. دو مجموعه داده با اندازگیری محلهای مشترک از نقاط که با نشانگر لیپیدی در طول MRI مشخص شده و در طول MEG مشخص میشوند به وسیله سیم پیچهای الکتریکی که میدان مغناطیسی را خاموش میکنند، ترکیب میشوند. مکانهای نقاط ثابت در هر مجموعه دادهها سپس برای تعریف یک سیستم مختصات مشترک استفاده میشود تا اطلاعات MEG عملکردی بر روی دادههای ساختاری امکانپذیر باشد.
انتقاد از استفاده از این تکنیک در عمل بالینی این است که آنها مناطق رنگی با مرزهای مشخصی که بر روی یک اسکن MRI قرار میگیرند، تولید میشود: بیننده بیتجربه ممکن است متوجه نشود که رنگها نشانگر فیزیولوژی قطعی نیستند به دلیل رزولوشن فضایی نسبتاً کم MEG، بلکه یک احتمال از فرایندهای آماری است. با این حال، هنگامی که تصویر منبع مغناطیسی دیگر اطلاعات را تأیید میکند، میتواند از ابزار بالینی مفید باشد.
محلیسازی منبع مدل دوقطبی
تکنولوژی مدلسازی منبع برای MEG شامل محاسبه مجموعهای از جریانهای دوقطبی معادل (به انگلیسی:ECD/equivalent current dipoles)است، که فرض میکند که منبع نورونی به صورت مرکزی میباشد. این روش مناسبسازی دوقطبی، غیرخطی و فرامعین است، از آنجا که تعداد پارامترهای ناشناخته دوقطبی کوچکتر از تعداد اندازهگیریهای MEG است. الگوریتمهای چندگانه اتوماتیک مانند طبقهبندی سیگنال چندگانه (به انگلیسی: multiple signal classification) و شروع چندگانه زمانی-مکانی (به انگلیسی:Multi Start Spatial and Temporal/مخفف:MSST) برای تحلیل واکنشهای MEG مورد استفاده قرار میگیرند. محدودیتهای مدلهای دوقطبی برای مشخص کردن پاسخهای عصبی:
- مشکلات در محلی سازی منابع توسعه یافته با ECDها
- مشکلات با دقت، برآورد کردن تعداد کل دو قطبیهای در پیش روی
- وابستگی به محل دو قطبی، به ویژه در عمق مغز.
تجزیه و تحلیل جزء مستقل (ICA)
تجزیه و تحلیل جزء مستقل (ICA) یکی دیگر از راه حل پردازش سیگنال است که سیگنالهای مختلفی را که از لحاظ آماری در زمان مستقل هستند جدا میکند. این عمدتاً برای حذف آثار از قبیل چشمک زدن، حرکت عضلانی چشم، آرتیفکت عضلانی صورت، ارتیفکت قلبی و غیره از سیگنالهای MEG و EEG که ممکن است با نویز بیرونی آلوده باشد حذف میشود. با این حال، ICA دارای وضوح ضعیف از منابع مغزی بسیار مرتبط است.
موارد استفاده
در تحقیقات، استفاده اولیه از MEG، دراندازهگیری دورههای زمانی فعالیت است. MEG میتواند حوادث را با دقت ۱۰ میلی ثانیه یا سریعتر مشخص کند، در حالی که MRI کارکردی(fMRI) که به تغییرات جریان خون بستگی دارد، در بهترین حالت ممکن است رویدادها را با دقت چند صد میلی ثانیه مشخص کند. MEG همچنین دقیقاً محل منابع را در قسمت شنوایی اولیه، سموتوسنسوری و ناحیه موتور مشخص میکند. برای ایجاد نقشههای کارکردی از کورتکس انسان در طول وظایف شناختی پیچیدهتر، MEG اغلب با fMRI همراه است، زیرا این روشها یکدیگر را تکمیل میکنند. دادههای نورونال (MEG) و همودینامیک (fMRI) لزوماً با وجود ارتباط نزدیک بین میدانهای پتانسیل محلی (LFP) و سیگنال وابسته به سطح اکسیداسیون خون (BOLD) موافق نیستند. سیگنال MEG و BOLD ممکن است از یک منبع منشأ گرفته شوند (هر چند سیگنال BOLD از طریق پاسخ همودینامیکی فیلتر میشود).
MEG برای محلی سازی بهتر پاسخهای در مغز نیز مورد استفاده قرار میگیرد. بازبودن تنظیمات MEG اجازه میدهد تا محرکهای شنوایی و بصری خارجی به آسانی معرفی شود. برخی از جنبشهای نمونه نیز امکانپذیراست تا زمانی که سر فرد تکان نخورده باشد. سپس پاسخها در مغز قبل، در طی و پس از ورود تحریک / تکانه میتواند با تفکیک مکانی بیشتر از آنچه که قبلاً با EEG امکانپذیر بود، نمایش داده شود. روانشناسان نیز از مزایای مورفولوژیک MEG برای درک بهتر روابط بین عملکرد مغز و رفتار استفاده میکنند. به عنوان مثال، تعدادی از مطالعات انجام شده در مقایسه با پاسخهای MEG بیماران مبتلا به مشکلات روحی برای کنترل بیماران انجام شدهاست. موفقیتهای بزرگی در جداسازی واکنشهای منحصر به فرد در بیماران مبتلا به اسکیزوفرنی، از قبیل نقص شنوایی در صداهای انسانی وجود داشتهاست.MEG همچنین برای پاسخ دادن به الگوی روانشناسی مانند وابستگی احساسی درک زبان استفاده میشود.
مطالعات اخیر طبقهبندی موفقیتآمیز بیماران مبتلا به مولتیپل اسکلروزیس، بیماری آلزایمر، اسکیزوفرنی، سندرم Sjögren، الکل بودن شدید و درد صورت را گزارش دادهاست. MEG میتواند برای تشخیص این بیماران از افراد سالم استفاده شود، که نشان دهنده نقش آینده MEG در تشخیص است.
صرع کانونی
استفاده بالینی از MEG در شناسایی و موضعگیری فعالیت پاتولوژیک در بیماران مبتلا به صرع و در محلیسازی آشکار کورتکس برای برنامهریزی جراحی در بیماران مبتلا به تومورهای مغزی یا صرع جدی است. هدف جراحی صرع حذف بافتهای اپیلوتوژن در حالی است که مناطق سالم مغز را خراب میکنند. دانستن موقعیت دقیق مناطق مغزی ضروری (مانند قشر اولیه مغز و قشر حسی اولیه، قشر بصری و مناطقی که در تولید و درک گفتاری دخیل هستند) به جلوگیری از نقص عصبی ناشی از جراحی کمک میکند. تحریک مستقیم کورتیکال و پتانسیل تحریک شده قشر حسی-حرکتی که در ECoG ضبط شدهاند، به عنوان استاندارد طلایی برای محلیسازی مناطق ضروری مغز در نظر گرفته میشوند. این روشها میتوانند به صورت همزمان یا با استفاده از شبکهٔ الکترودهایی که در subdural قرار گرفتهاند، انجام شوند. هر دو آنها تهاجمی هستند مکانیزمهای غیرتهاجمی MEG محلیسازی میکنند مرکز شیارهای مغزی را که حاصل از تحریک میدانهای مغناطیسی در بخش حسی-حرکتی میباشند، که تشابه زیادی با ضبطهای تهاجمی را نشان میدهند. مطالعات MEG در طبقهبندی کارکردی قشر حسی-حرکتی اولیه و ترسیم محدوده فضایی قشر حسی-حرکتی دست با تحریک فرد کمک میکند. این تشابه بین محلی سازی تهاجمی بافتهای کورتکس و MEG ثبت شدهاثربخشی تحلیل MEG را نشان میدهد و نشان میدهد که MEG میتواند روشهای تهاجمی را در آینده جایگزین کند.
جنین
MEG برای مطالعه فرایندهای شناختی نظیر دید، تست و پردازش زبان در جنینها و نوزادان مورد استفاده قرار گرفتهاست.
مقایسه با تکنیکهای مرتبط
MEG از دهه ۱۹۶۰ در حال توسعه است اما پیشرفتهای اخیر در الگوریتمهای محاسباتی و سختافزار کمک زیادی کردهاست و وعده دادهاست که رزولوشن مکانی ایجاب شده همراه با رزولوشن زمانی بسیار بالا (بهتر از ۱ میلی ثانیه) را بهبود بخشد. از آنجا که سیگنال MEG حاصل اندازهگیری مستقیم فعالیتهای عصبی است، رزولوشن زمانی آن با الکترودهای داخل جمجمه قابل مقایسهاست.MEG مکمل روشهای اندازهگیری دیگر فعالیت مغز مانند الکتروانسفالوگرافی (EEG)، توموگرافی انتشار پوزیترون (PET) و fMRI است. نقاط قوت آن شامل مستقل بودن ان نسبت به هندسه سر در مقایسه با EEG است (مگر اینکه ایمپلنتهای فرومغناطیس وجود داشته باشد)، غیر تهاجمی، استفاده از هیچ تابش یونیزه، در مقایسه با PET و رزولوشن زمانی بالا نسبت به fMRI است.
منابع
ویکیپدیای انگلیسی en:Magnetoencephalography
