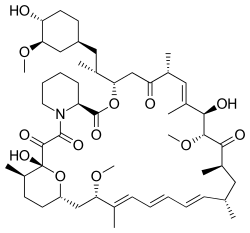
سیرولیموس
سیرولیموس (انگلیسی: Sirolimus) یا راپامایسین یک داروی ماکرولید است که برای آغشتهسازی استنتهای شریانهای کرونر قلب، جلوگیری از ردِ پیوند اعضاء و درمان نوعی بیماری ریوی نادر به نام «لنفانژیولیومیوماتوز» بهکار میرود.[4][5][6]
 | |
|---|---|
 | |
| سامانهشناسی نام (آیوپاک) | |
| (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E, 30S,32S,35R)-1,18-dihydroxy-12-{(2R)-1-[(1S,3R, 4R)-4-hydroxy-3-methoxycyclohexyl]-2-propanyl}- 19,30-dimethoxy-15,17,21,23,29,35-hexamethyl- 11,36-dioxa-4-azatricyclo[۳۰٫۳٫۱٫۰~۴٬۹~]hexatria conta-16,24,26,28-tetraene-2,3,10,14,20-pentone | |
| دادههای بالینی | |
| نام تجاری | Rapamune |
| Licence data | EMA:Link, US FDA:link |
| رده بارداری | C(US) |
| تجویز | دهانی |
| دادههای فارماکوکینتیکی | |
| فراهمی زیستی | ۱۴٪ (محلول خوراکی)، با غذاهای پُرچرب، کمتر؛ ۱۸٪ (قرص)، غذاهای پُرچرب، بیشتر[1] |
| پیوند پروتئینی | ۹۲٪ |
| متابولیسم | کبدی |
| نیمهعمر | ۵۷ تا ۶۳ ساعت[2] |
| دفع | بیشتر از طریق مدفوع |
| شناسه | |
| شماره سیایاس | 53123-88-9 |
| کد ATC | L04AA10 S01XA23 (WHO) |
| پابکم | CID 5284616 |
| بانکدارو | DB00877 |
| کماسپایدر | 10482078 |
| UNII | W36ZG6FT64 |
| KEGG | D00753 |
| ChEBI | CHEBI:۹۱۶۸ |
| ChEMBL | CHEMBL413 |
| مترادفها | Rapamycin |
| دادههای شیمی | |
| فرمول | C51H79NO۱۳ |
| وزن مولکولی | ۹۱۴٫۱۷۲ گرم بر مول |
| SMILES | eMolecules & PubChem |
| |
| Physical data | |
| محلول در آب | ۰٫۰۰۲۶[3] mg/mL (20 °C) |
| | |
سیرولیموس، نوعی داروی سرکوبکننده سیستم ایمنی است و در انسان، در جلوگیری از ردِ پیوند کلیه کاربرد ویژهای دارد.
این دارو از طریقِ کاهشِ تولید اینترلوکین ۲، فعالشدگیِ لنفوسیتهای تی و لنفوسیتهای بی را مهار میکند.
سیرولیموس توسط نوعی باکتری بهنام «استرپتومایسیس هایگروسکوپیکوس» ساخته میشود و نخستین بار در سال ۱۹۷۲ میلادی توسط «سورندرا نات سگال» و همکارانش از نمونههایی از این باکتری که در جزیره ایستر یافت شده بود، جداسازی شد[7][8] و آنرا راپامایسین نام نهادند که از نامِ محلی این جزیره «راپا نوئی» الهام گرفته شده بود.[5] در آغاز این مولکول را بهعنوان یک داروی ضدقارچ توسعه و تکامل بخشیدند؛ اما بهسرعت دریافتند که این دارو با مهار «mTOR»، خواص سرکوبکنندهٔ ایمنی و ضد تزاید سلولی دارد. سازمان غذا و دارو این دارو را در سپتامبر ۱۹۹۹ میلادی مورد تأیید قرار داد.
شایعترین عوارض این دارو (بروز بیش از ۳۰٪ مورد) در بیماران پیوند کلیوی عبارتند از: ادم محیطی، هیپرکلسترولمی، فشار خون بالا، شکمدرد، سردرد، تهوع، اسهال، درد، یبوست، هیپرتریگلیسریدمی، افزایش کراتینین، تب، عفونت ادراری، کمخونی، آرترالژی و ترومبوسیتوپنی.[4]
شایعترین عوارض این دارو (بروز بیش از ۲۰٪ مورد) در بیماران لنفانژیولیومیوماتوز عبارتند از: ادم محیطی، هیپرکلسترولمی، شکمدرد، سردرد، تهوع، اسهال، درد قفسهٔ سینه، استوماتیت، سرماخوردگی، عفونت دستگاه تنفسی فوقانی، سرگیجه و درد ماهیچه.[4]
درمان با سیرولیموس احتمالِ ابتلا به دیابت نوع ۲ را افزایش میدهد.[9] عارضهٔ جدی این دارد، مسمومیت ریوی است؛[10][11][12][13][14][15][16] بهویژه در افرادی که پیوند ریه شدهاند.[17]
سازمان غذا و دارو میگوید که این دارو خطر ابتلا به سرطان پوست ناشی از اشعهٔ آفتاب و همچنین لنفوم را افزایش میدهد. بافت چربی نقش اصلی در هموستاز انرژی و متابولیسم لیپیدها و غیره دارد. همچنین به عنوان یک عضو غدد درون ریز برای تنظیم ترشح طیف گستردهای از عواملی مانند لپتین، آدیپونکتین، فاکتور نکروز تومور گاما و سایتوکاین های مختلفی عمل می کند، که برخی از آنها تنظیم کننده اصلی هموستاز انرژی هستند . رده سلولی 3T3-L1 معمولاً به عنوان یک سیستم مدل تمایز چربی برای بررسی مکانیسمهای مولکولی تنظیم چربی استفاده میشود که در این رده سلولی بعد از افزودن انسولین، گلوکوکورتیکوئیدها و تقویت کننده cAMP یک آبشار نظارتی رونویسی را آغاز میکند که منجر به بیان ژنهای مختص چربی میشود. چندین فاکتور مهم رونویسی در سنتز چربی عبارتند از جمله CCAAT / تقویت پروتئین های اتصال دهنده(C / EBP) بتا ، سیگما و آلفا و گیرنده پراکسیزوم فعال شده گاما (گاما PPAR). محرکهای اگزوژن باعث بیان C / EBP بتا و سیگما در سلولهای پیش از چربی می شوند و اینها به نوبه خود سبب القاء گاما PPAR و C / EBP آلفا میشوند و در ادامه این دو ژن القا شده، ژنهای مهم چربی مورد نیاز برای عملکرد چربی را فعال می کنند. در چربیها، تصور می شود ژن مورد هدف راپامایسین در پستانداران (mTOR) سنتز پروتئین، مورفوژنز بافت چربی و سنتز / ترشح لپتین را تنظیم می کند.
mTOR یک سرین و ترئونین کیناز حفظ شده میباشد که رشد سلولی و پیشرفت چرخه سلولی از طریق مسیر فسفوتیدیل 3 کیناز (PI3K) و پروتئین کینازB تنظیم میکند. عامل تضعیفکننده سیستم ایمنی و ضد تکثیر و راپامایسین از طریق مهارmTOR سیگنالهای لازم برای پیشرفت چرخه سلولی، رشد سلولی، تکثیر سلولی و رگ سازی را مهار مینماید. گرچه راپامایسین به خصوص در سرطانها نقش تقویتکننده آپوپتوز را دارد، شواهدی هم مبنی بر اینکه راپامایسین میتواند خواص ضد آپوپتوزی از طریق عملکردش در تنظیم مرگ سلولی بسته به نوع سلول و سطح فعالیت و همچنین تنظیم اهداف مولکولهای ضد آپوپتوز نظیر p35و پروتئین های Bcl-2 ایفا نماید وجود دارد. گزارش شده است که راپامایسین باعث تمایز تمایز سلولهای 3T3-L1 میشود که دلالت بر نقش mTOR در چربی زایی دارد. دو کمپلکس پروتئین چندگانه مجزا mTORC1 و mTORC2، چندین رویداد سلولی از جمله رشد و تکثیر سلول را هدایت میکنند. mTORC1 شامل رپتور ، و mLST8 / GbL و PRAS40 است، در حالی که mTORC2 شامل رپتور،sin1 ، protor و mLST8 / GbL بوده و نسبت به راپامایسین حساس نمیباشد.
سیگنالینگ mTORC1 به منظور کنترل رشد، تکثیر و بقا سلولی توسط محرک های متنوعی مانند فاکتورهای رشد، مواد مغذی و محرکهای انرژی فعال میشود. mTORC1 نسبت به راپامایسین حساس بوده و سبب مهار فاکتور شروع یوکاریوتی اتصال پروتئین (4E-BP) و فعالسازی ریبوزوم S6 کیناز1 (S6K1) که در ترجمه mRNA نقش دارند میشود. S6K1 باعث فعالسازی eIF4E میشود که eIF4E نیز عامل فعالسازی و القاء گاما PPAR و بیان C / EBP آلفا شده و از طریق مکانیسم ناشناختهای سبب فعالسازی C / EBP بتا و سیگما در سلولهای پیش از چربی میشوند. C / EBP بتا، سیگما و آلفا میتوانند وارد هسته شوند و همگی به C / EBP آلفا تبدیل میشوند و در مرحله بعد نوع آلفا به PPAR گاما تبدیل شده و در ادامه سبب بیوسنتز لیپیدهایی که برای حفظ هموستاز سلولی ضروری هستند میشود. همچنینmTORC1 باعث تمایز چربی، افزایش تنفس میتوکندری و سرکوب لیپولیز میشود. نقص در سنتز یا پردازش چربی در ایجاد بسیاری از بیماریها از جمله چاقی، مقاومت به انسولین، دیابت نوع 2 و سرطان نقش دارد. در نتیجه با توجه به اینکه سیگنالیگ پایین دست mTOR، مسیرهای آنابولیکی هستند که انرژِی زیادی جهت سنتز (برای مثال سنتز پروتئین و لیپید) مصرف میکنند، اگردرعوامل بالا دستmTOR جهش با اختلالاتی صورت گیرد، که باعث افزایش بیان و فعالیت mTORC1 شود، سبب اختلالات سلولی و بیماری میشوند. بهترین راهکار، استفاده از داروی راپامایسین است، زیرا مهار mTORC1 با راپامایسین می تواند از القای بیوژنز ریبوزوم، تمایز و تجمع لیپیدها، مقاومت به انسولین و بروز سرطان جلوگیری کند.[18]
.[4]
منابع
- Buck ML (2006). "Immunosuppression With Sirolimus After Solid Organ Transplantation in Children". Pediatric Pharmacotherapy. 12 (2).
- "Rapamycin". PubChem Compound. National Center for Biotechnology Information. Retrieved 1 August 2016.
- Simamora P, Alvarez JM, Yalkowsky SH (February 2001). "Solubilization of rapamycin". International Journal of Pharmaceutics. 213 (1–2): 25–9. doi:10.1016/s0378-5173(00)00617-7. PMID 11165091.
- "Rapamune Prescribing Information" (PDF). United States Food and Drug Administration. Wyeth Pharmaceuticals, Inc. May 2015. Retrieved 28 May 2016.
- Vézina C, Kudelski A, Sehgal SN (October 1975). "Rapamycin (AY-22,989), a new antifungal antibiotic. I. Taxonomy of the producing streptomycete and isolation of the active principle". The Journal of Antibiotics. 28 (10): 721–6. doi:10.7164/antibiotics.28.721. PMID 1102508.
- "Cypher Sirolimus-eluting Coronary Stent". Cypher Stent. Archived from the original on 23 November 2008. Retrieved 1 April 2008.
- Seto B (November 2012). "Rapamycin and mTOR: a serendipitous discovery and implications for breast cancer". Clinical and Translational Medicine. 1 (1): 29. doi:10.1186/2001-1326-1-29. PMC 3561035. PMID 23369283.
- Pritchard DI (May 2005). "Sourcing a chemical succession for cyclosporin from parasites and human pathogens". Drug Discovery Today. 10 (10): 688–91. doi:10.1016/S1359-6446(05)03395-7. PMID 15896681.
- Johnston O, Rose CL, Webster AC, Gill JS (July 2008). "Sirolimus is associated with new-onset diabetes in kidney transplant recipients". Journal of the American Society of Nephrology. 19 (7): 1411–8. doi:10.1681/ASN.2007111202. PMC 2440303. PMID 18385422.
- Chhajed PN, Dickenmann M, Bubendorf L, Mayr M, Steiger J, Tamm M (2006). "Patterns of pulmonary complications associated with sirolimus". Respiration. 73 (3): 367–74. doi:10.1159/000087945. PMID 16127266.
- Morelon E, Stern M, Israël-Biet D, Correas JM, Danel C, Mamzer-Bruneel MF, Peraldi MN, Kreis H (September 2001). "Characteristics of sirolimus-associated interstitial pneumonitis in renal transplant patients". Transplantation. 72 (5): 787–90. doi:10.1097/00007890-200109150-00008. PMID 11571438.
- Filippone EJ, Carson JM, Beckford RA, Jaffe BC, Newman E, Awsare BK, Doria C, Farber JL (September 2011). "Sirolimus-induced pneumonitis complicated by pentamidine-induced phospholipidosis in a renal transplant recipient: a case report". Transplantation Proceedings. 43 (7): 2792–7. doi:10.1016/j.transproceed.2011.06.060. PMID 21911165.
- Pham PT, Pham PC, Danovitch GM, Ross DJ, Gritsch HA, Kendrick EA, Singer J, Shah T, Wilkinson AH (April 2004). "Sirolimus-associated pulmonary toxicity". Transplantation. 77 (8): 1215–20. doi:10.1097/01.TP.0000118413.92211.B6. PMID 15114088.
- Mingos MA, Kane GC (December 2005). "Sirolimus-induced interstitial pneumonitis in a renal transplant patient" (PDF). Respiratory Care. 50 (12): 1659–61. PMID 16318648. Archived from the original (PDF) on 22 July 2012. Retrieved 30 December 2017.
- Das BB, Shoemaker L, Subramanian S, Johnsrude C, Recto M, Austin EH (March 2007). "Acute sirolimus pulmonary toxicity in an infant heart transplant recipient: case report and literature review". The Journal of Heart and Lung Transplantation. 26 (3): 296–8. doi:10.1016/j.healun.2006.12.004. PMID 17346635.
- Delgado JF, Torres J, José Ruiz-Cano M, Sánchez V, Escribano P, Borruel S, María Cortina J, de la Calzada CS (September 2006). "Sirolimus-associated interstitial pneumonitis in 3 heart transplant recipients". The Journal of Heart and Lung Transplantation. 25 (9): 1171–4. doi:10.1016/j.healun.2006.05.013. PMID 16962483.
- McWilliams TJ, Levvey BJ, Russell PA, Milne DG, Snell GI (February 2003). "Interstitial pneumonitis associated with sirolimus: a dilemma for lung transplantation". The Journal of Heart and Lung Transplantation. 22 (2): 210–3. doi:10.1016/S1053-2498(02)00564-8. PMID 12581772.
- Chakrabarti, P., & Kandror, K V (February 2015). "The role of mTOR in lipid homeostasis and diabetes progression. Current Opinion in Endocrinology & Diabetes and Obesity": 340–346. doi:10.1097/MED.0000000000000187. PMID 12581772. Vancouver style error: non-Latin character (help)
- مشارکتکنندگان ویکیپدیا. «Sirolimus». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۳۰ دسامبر ۲۰۱۷.