طراحی پروتئین
طراحی پروتئین (به انگلیسی Protein design)، طراحی منطقی (rational design) مولکولهای جدید پروتئین است که به ساختار پروتئین هدف (با هدف طراحی عملکرد یا رفتار جدید) تبدیل میشود. پروتئینها میتوانند از ابتدا طراحی شوند (de novo design) یا با ساختن مدلهای محاسبه شده از یک ساختار پروتئینی شناخته شده و توالی آن طراحی شوند (طراحی مجدد پروتئین).
روشهای طراحی منطقی پروتئین، توالی پروتئینی را پیشبینی میکند که به ساختارهای اختصاصی تبدیل میشود. سپس این توالیهای پیشبینی شده میتوانند به صورت تجربی از طریق روشهایی نظیر سنتز پپتید، موتاژنز جهت دار جایگاه (site-directed mutagenesis) یا سنتز ژن مصنوعی مورد تأیید قرار گیرد.
طراحی منطقی پروتئین به اواسط دهه ۱۹۷۰ بازمیگردد، هرچند روشهای اولیه طراحی پروتئین بیشتر بر پایه ترکیب توالی قرار میگرفتند و برهمکنشهای اختصاصی بین زنجیرههای جانبی در سطح اتمی حساب نمیشد. با این حال اخیراً، پیشرفت در میدان نیروی مولکولی، الگوریتمهای طراحی پروتئین و بیوانفورماتیک ساختاری (structural bioinformatics) مانند کتابخانههایی از کانفورماسیونهای اسید آمینه، توسعه ابزارهای محاسباتی پیشرفته طراحی پروتئین را امکانپذیر کردهاست. این ابزار محاسباتی میتواند محاسبات پیچیدهای را در مورد انرژی و انعطافپذیری پروتئین انجام دهد و جستجوها را در فضاهای پیکربندی وسیعی انجام دهد، که انجام آن به صورت دستی غیرممکن است.
با توجه به پیشرفت برنامههای محاسباتی طراحی پروتئین و موفقیتهای مهم در این زمینه، طراحی منطقی پروتئین یکی از مهمترین ابزارهای مهندسی پروتئین شدهاست.
تاریخچه
هدف در طراحی منطقی پروتئین، پیشبینی توالیهای اسید آمینه است که به یک ساختار پروتئینی خاص تبدیل میشود. طراحی پروتئین شامل شناسایی توالیهای جدید در این زیر مجموعه است. حالت بومی یک پروتئین، کمترین انرژی آزاد ترکیبی برای زنجیره است؛ بنابراین، طراحی پروتئین جستجو برای توالیهایی است که ساختاری را با حداقل انرژی آزاد انتخاب میکند. به یک معنا، معکوس پیشبینی ساختار پروتئین است. در طراحی، یک ساختار ثانویه تعیین میشود و توالی ای که به آن فولد خواهد شد شناسایی میشود. از این رو، فولد شدن معکوس نیز نامیده میشود. طراحی پروتئین یک مسئله بهینهسازی است با استفاده از معیارهای امتیاز دهی، توالی بهینهسازی شده که به ساختار مورد نظر فولد خواهد شد، انتخاب میشود.
هنگامی که اولین پروتئین در طول دهه ۱۹۷۰ و ۱۹۸۰ بهطور منطقی طراحی شد، توالی آن به صورت دستی بر اساس تجزیه و تحلیل پروتئینهای شناخته شده، ترکیب توالی، بار اسید آمینه و هندسه ساختار مورد نظر بهینه شد.
اولین پروتئین طراحی شده به Bernd Gutte مربوط میشود که ریبونوکلئاز گاو و ساختارهای ثانویه شامل صفحات بتا (beta-sheets)وآلفا هلیکس حاوی یک اتصال دهنده DDT را طراحی کردهاست. Urry و همکارانش بعداً پپتیدهای فیبری الاستین مشابه را بر اساس قوانین ترکیب توالی طراحی کردند. ریچاردسون و همکاران یک پروتئین ۷۹ زیرواحدی را بدون هومولوژی توالی پروتئین شناخته شده، طراحی کردند.[1]
در دهه ۱۹۹۰، ظهور رایانههای قدرتمند، کتابخانه ایی از کانفورماسیونهای اسید آمینه و میدانهای نیرویی که عمدتاً برای شبیهسازیهای دینامیکی مولکولی توسعه یافته بود، توسعه ابزارهای محاسباتی طراحی پروتئین مبتنی بر ساختار را امکانپذیر ساخت. . پس از توسعه این ابزار محاسباتی، موفقیتهای بزرگ در طراحی پروتئین در ۳۰ سال گذشته به دست آمدهاست. اولین پروتئین کاملاً نوین (de novo) بهطور موفقیتآمیز توسط Stephen Mayo و همکارانش در سال ۱۹۹۷ طراحی شد.[2] و کمی بعد در سال ۱۹۹۹، Peter S. Kim و همکارانش، دایمر، ترایمر و تترامرهای مارپیچی (coiled coil) غیرمعمول راست گرد را طراحی کردند.[3][4]
در سال ۲۰۰۳، آزمایشگاه David Baker، یک پروتئین کامل را با فولدی (fold) که ازقبل در طبیعت دیده نشده بود طراحی کرد.[5] بعدها، در سال ۲۰۰۸، گروه Baker به صورت محاسباتی طراحی آنزیمها را برای دو واکنش مختلف انجام داد.[6] در سال ۲۰۱۰ با استفاده از پروب پروتئینی طراحی شده به صورت محاسباتی، یکی از قویترین آنتیبادیهای خنثیکننده بهطور گسترده از سرم بیمارجدا شد.[7] با توجه به این موفقیتها طراحی پروتئین یکی از مهمترین ابزارهای موجود برای مهندسی پروتئین است..
مدلهای پایهای ساختار و عملکرد پروتئین
اگرچه برنامههای طراحی پروتئین بسیار متفاوت هستند، اما چهار سؤال اصلی مدل سازی باید مطرح میشود: ساختار هدف (target structure) این طراحی چیست، چه انعطافپذیری در ساختار هدف مجاز است، کدام توالیها در جستجو وجود دارد، کدام میدان نیروی مورد استفاده قرار میگیرد تا توالی و ساختارثبت شود.
ساختار هدف
عملکرد پروتئین به شدت وابسته به ساختار پروتئین است و طراحی منطقی پروتئین از این رابطه استفاده میکند تا از طریق طراحی پروتئینی که یک ساختار یا فولد هدف دارد، عملکرد را طراحی کند؛ بنابراین، در تعریف، در طراحی منطقی پروتئین، ساختار هدف یا مجموعه ساختارها بایداز قبل شناخته شود.
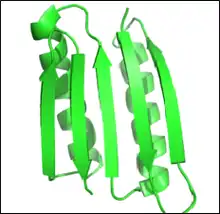
فضای توالی
در طراحی منطقی پروتئین، پروتئینها میتوانند از توالی و ساختار یک پروتئین شناخته شده مجدد طراحی شوند یا پروتئین کاملاً از ابتدا (de novo) طراحی شوند. در طراحی مجدد پروتئین، بسیاری از زیرواحدها در توالی به عنوان اسیدآمینه وحشی باقی میمانند، درحالیکه تعداد کمی از آنها مجاز به جهش هستند. در طراحی de novo، تمام توالی دوباره بر اساس هیچ توالی قبلی طراحی میشود. هر دو طرح نو و طراحی مجدد پروتئین میتوانند قواعدی در فضای توالی ایجاد کنند.
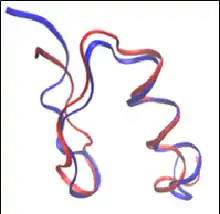
انعطافپذیری ساختار
پارامتر اساسی هر فرایند طراحی مقدار انعطافپذیری مجاز برای زنجیرههای جانبی و ستون (backbone) است. در سادهترین مدلها، ستون پروتئین، سفت و محکم نگه داشته میشود، در حالی که بعضی از زنجیرههای جانبی پروتئینی مجاز به تغییرکانفورماسیون (conformation) هستند. با این حال، زنجیرهای جانبی میتوانند در طولهای پیوند، زاویه پیوند و زاویه دو بعدی، از درجه آزادی برخوردار باشند. برای سادهسازی این فضا، روشهای طراحی پروتئین از کتابخانههای روتامر(Rotamer) استفاده میکنند که مقادیر ایدئال برای طول پیوند و زاویه پیوند را در نظر میگیرند.
عملکرد انرژی
تکنیکهای طراحی پروتئین هوشمندانه باید قادر باشد توالیهایی که در فولد هدف پایدار باقی میمانند از آنهایی که حالتهای رقابتی کم انرژی دیگر را ترجیح میدهند، تشخیص دهد.
کاربردها و نمونههایی از پروتئین طراحی شده
طراحی آنزیم
بهطور کلی، طراحی ساختار پروتئین میتواند متفاوت از طراحی آنزیم باشد، زیرا در طراحی آنزیمها باید بسیاری از حالتهای درگیر در مکانیسم کاتالیزوری را در نظر گرفته شود.[8]
طراحی برای همبستگی (Design for affinity)
برهمکنشهای پروتئین-پروتئین در اکثر فرایندهای زیستی دخیل هستند. بسیاری از بیماریها مانند آلزایمر، بسیاری از اشکال سرطان (مثلاً TP53) و عفونت ویروس اچ آی وی (HIV) شامل برهمکنش پروتئین و پروتئین است؛ بنابراین، برای درمان چنین بیماریها، با طراحی داروهای پروتئینی یا شبهه پروتئینی که به یکی از عوامل شرکتکننده در برهمکنش متصل شود و در نتیجه باعث اختلال در برهمکنش ایجادکننده بیماری میشود.
طراحی پروتئینهای غشایی
پروتئینهای غشایی بهطور ذاتی سخت طراحی میشوند، بیشتر به علت اینکه تأیید طراحیها به صورت آزمایشی سخت است.
منابع
- 1- Richardson, JS; Richardson, DC (July 1989). "The de novo design of protein structures.". Trends in Biochemical Sciences. 14 (7): 304–9. PMID 2672455. doi:10.1016/0968-0004(89)90070-4.
- 2- ^ Jump up to:a b c Dahiyat, BI; Mayo, SL (October 3, 1997). "De novo protein design: fully automated sequence selection.". Science. 278 (5335): 82–7. PMID 9311930. doi:10.1126/science.278.5335.82.
- 3- ^ Jump up to:a b Gordon, DB; Marshall, SA; Mayo, SL (August 1999). "Energy functions for protein design.". Current Opinion in Structural Biology. 9 (4): 509–13. PMID 10449371. doi:10.1016/s0959-440x(99)80072-4.
- 4- ^ Jump up to:a b Harbury, PB; Plecs, JJ; Tidor, B; Alber, T; Kim, PS (November 20, 1998). "High-resolution protein design with backbone freedom.". Science. 282 (5393): 1462–7. PMID 9822371. doi:10.1126/science.282.5393.1462.
- 5- ^ Jump up to:a b c Kuhlman, B; Dantas, G; Ireton, GC; Varani, G; Stoddard, BL; Baker, D (November 21, 2003). "Design of a novel globular protein fold with atomic-level accuracy.". Science. 302(5649): 1364–8. Bibcode:2003Sci...302.1364K. PMID 14631033. doi:10.1126/science.1089427.
- 6- Jump up^ Sterner, R; Merkl, R; Raushel, FM (May 2008). "Computational design of enzymes.". Chemistry & Biology. 15 (5): 421–3. PMID 18482694. doi:10.1016/j.chembiol.2008.04.007.
- 7- Jump up^ Wu, X; Yang, ZY; Li, Y; Hogerkorp, CM; Schief, WR; Seaman, MS; Zhou, T; Schmidt, SD; Wu, L; Xu, L; Longo, NS; McKee, K; O'Dell, S; Louder, MK; Wycuff, DL; Feng, Y; Nason, M; Doria-Rose, N; Connors, M; Kwong, PD; Roederer, M; Wyatt, RT; Nabel, GJ; Mascola, JR (August 13, 2010). "Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1.". Science. 329 (5993): 856–61. Bibcode:2010Sci...329..856W. PMC 2965066. PMID 20616233. doi:10.1126/science.1187659.
- 8- Baker, D (October 2010). "An exciting but challenging road ahead for computational enzyme design.". Protein science: a publication of the Protein Society. 19 (10): 1817–9. PMC 2998717. PMID 20717908. doi:10.1002/pro.481.
