کلاژن
کُلاژِن (به انگلیسی: Collagen) پروتئینی است که در محیط خارج از سلولهای مختلف گونههای مختلف موجودات، وجود دارد. پروتئین کلاژن به صورت رشتههای کلاژن مشاهده میشود. رشتههای کلاژن در همه انواع بافت پیوندی نیز وجود دارند ، ولی به میزان متفاوت یافت میشوند. سنتز کلاژن بهوسیله فیبروبلاستها مشابه ساخت سایر پروتئینها میباشد. سنتز کلاژن توسط سلولهای استئوبلاست در استخوان، کندروبلاست در غضروف، ادونتوبلاست در دندان، سلولهای ماهیچه صاف در دیواره رگهای خونی و سلولهای اپی تلیال نیز انجام میگیرد. ترکیب اسید آمینه تشکیل دهنده کلاژن در بافتهای مختلف دارای تفاوتهای جزئی است.گلایسین بیشترین آمینو اسید موجود در آن است.
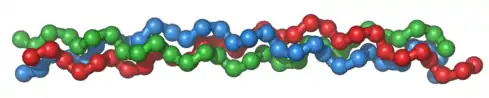
ساختار مارپیچ سه رشتهای کلاژن
یک مولکول کلاژن از سه زنجیرهٔ پروتئینی تشکیل شده که به دور یک دیگر پیچیدهاند. مولکولهای کلاژن به گونهای ویژه کنار یکدیگر آرایش مییابند و یک ریز رشته را میسازند. تعداد زیادی از این ریز رشتهها به دور یکدیگر میپیچند تا یک رشتهٔ کلاژن ساخرصد پرولین و هیدروکسی پرولین و یک اسید آمینه غیر استاندارد است.
متابولسیم و بیوسنتز کلاژن
کلاژن سختترین رشته بافت پیوندی است و با آنزیم کلاژناز (حلکننده کلاژن) از بین میرود ترمیم آن بسیار سخت است و به زمان طولانی نیاز دارد. چون یک پروتئین است در درون سلول ساخته شده و به بیرون از سلول تراوش میشود. فیبروبلاست مسئول ساختن اسید آمینه و سپس زنجیر پلی پپتید و مولکول پروکلاژن است. هر پروکلاژن در مدت پنج تا شش دقیقه ساخته شده و سپس به خارج از سلول حمل میشوند. پروکلاژن تحت اثر آنزیم پروکلاژن پپتیداز به تروپوکلاژن تبدیل میشود. تروپوکلاژن پلیمریزه شده کلاژن را میسازد. اسید هیالورونیک که از انواع ماده زمینه بیشکل است از پراکنده شدن بیهوده کلاژن در بین سلولها جلوگیری میکنند.
انواع کلاژن
دست کم ۱۳ نوع کلاژن در انسان شناسایی شدهاند که هر کدام در بافت خاصی وجود دارند. تنوع این کلاژنها به دلیل تفاوت در ماهیت پلی پپتیدهای تشکیل دهنده آنهاست. از کنار هم قرار گرفتن مارپیچهای کلاژن رشتههای کلاژن بهوجود میآیند. نحوه قرار گرفتن مارپیچها طوری است که انتهای مولکولهای مجاور روی هم قرار میگیرند. این نحوه قرارگیری باعث میشود که رشتههای کلاژن قابلیت کشش زیادی داشته باشند. دستجات متراکم این رشته که در تاندون وجود دارند با قابلیت کشش خود میتوانند نیروهای زیادی را تحمل کنند.
معروفترین انواع کلاژن
- کلاژن نوع I: این نوع کلاژن در استخوان و وتر وجود دارد و از تعداد زیادی دستههای فیبری ساخته شدهاست که به صورت امواج دریا قرار دارند.
- کلاژن نوع II: که در غضروف شفاف دیده میشود به شکل فیبریل است و فیبر تشکیل نمیشود.
- کلاژن نوع III: همان رشته شبکهای است که در غشای پایه دیده میشود این نوع کلاژن از فیبرهای واحد ساخته شدهاست.
- کلاژنهای نوع V,IV: به صورت فیبریل نبوده و احتمالاً غیر پلیمریزه هستند. کلاژن نوع IV در غشای پایه و نوع V در جدار رگهای خونی جنین یافت میشود.
کلاژن در استخوان
رشتههای کلاژن با مواد گوناگونی در هم میآمیزند. برای نمونه، کلاژن در استخوان با بلورهای کلسیم در هم میآمیزد و ساختار سختی میسازد. در نگاهی دقیقتر، استخوان مانند یک بتن مسلح به نظر میرسد که رشتههای کلاژن آن مانند میلگردهای فولادی بتن، درون سیمانی از بلورهای هیدروکسی آپاتیت Ca۱۰(PO۴)۶(OH)۲ و پروتئینهای نارشتهای از جمله اوستئوپونتین(osteopontin) و اوستئوکلسین(osteocalcin)جای گرفتهاند.
کلاژن در غضروف
در غضروفها، کلاژن در مادهٔ زمینهای ژل مانندی قرار میگیرد. مادهٔ زمینهٔ غضروف از مولکولهایی به نام پروتئوگلیکان (proteoglycan) تشکیل شدهاست. مولکولهای پروتئوگلیکان اسکلت پروتئینی میلهای شکلی دارند که شاخههای بسیاری از جنس کربوهیدرات به آن متصل هستند. زنجیرههای قندی پروتئوگلیکانها بارهای منفی فراوانی دارند و بنابراین ابر متراکمی از کاتیونها (مانند + Na) در پیرامون آنها شکل میگیرد. این ابر باعث میشود مقدار زیادی آب به مادهٔ زمینه جذب شود و محیط ژل مانندی را فراهم کند که برای تحمل فشار بسیار مناسب است. رشتههای کلاژنی که در این محیط پرآب جای دارند باعث مقاومت چندسازه در برابر کشش میشوند. غضروف گوش خارجی نسبت به غضروف مفصل زانو به انعطافپذیری بیشتری نیاز دارد. رشتههای کشسانی در غضروف گوش وجود دارد که از پروتئینی به نام الاستین(elastin)ساخته شدهاند. رشتههای الاستین در دیوارهٔ رگها و پوست نیز وجود دارند و به این چند سازهها خاصیت کشسانی میبخشند؛ بنابراین، پروتئینهای رشتهای کلاژن و الاستین با قرار گرفتن در مادهٔ زمینهای گوناگون، چند سازههایی با ویژگیهای جادویی میآفرینند. البته، آرایش رشتههای پروتئینی نیز در تعیین ویژگیهای چند سازههای بدن مؤثر است. برای نمونه، در رباطها و زردپیها، رشتههای کلاژن با آرایش منظمی از درازا کنار یکدیگر ردیف شدهاند. این آرایش به دسته کردن چند ترکهٔ چوب میماند که شکستن آنها را دشوار میسازد.
بیماریهای مرتبط با کلاژن
اختلالات کلاژن بعضی از بیماریهای ژنتیکی به علت تغییر در بین توالی اسید آمینه و ساختمان سه بعدی موجود در کلاژن، ایجاد میشوند. استئوژنز ایمپرفکتا با تشکیل غیرطبیعی استخوان در اطفال مشخص شده و سندروم اهلر-دانلوس همراه با مفاصل شل میباشد. هر کدام از این حالات میتوانند کشنده باشند.
تاکنون ۱۵ نوع کلاژن در انسان شناسایی شدهاست. ژنهای مختلفی پپتیدهای سازنده انواع مختلف کلاژن را کد میکنند که جهش در هر یک از آنها منجر به بیماری خاصی میشود. برای مثال کلاژن نوع یک از فیبریلهای سه رشتهای شامل دو پپتید آلفا-۱ و یک پپتید آلفا-۲ تشکیل شدهاست. جهش در ژنهای سازنده این دو پپتید بر حسب محل جهش (در پپتیدهای سازنده کلاژن توالی gly-X-Y تکرار شدهاست و موتاسیون در Gly منجربه بیماری سخت تری میشود) منجر به انواع مختلف بیماریهای استئوژنز ایمپرفکتا (نوع I تا V) و سندروم اهلرز دانلوس (نوع VII) میشود.
- درکلاژن نوع II، جهش در مناطق مختلف ژن (COL2A۱ (۱۲q۱۳ منجر به بیماریهای
Spondylephyseal Dysplasia, Stickler Syndrome, Kniest Dysplasiaو Achondrogenesis II میشود.
- در کلاژن نوع III، جهش در ژن (COL3A۱ (۲q۳۱ منجر به بیماری اهلرز دانلوس نوع IV میشود.
- در کلاژن نوع IV، جهش در ژنهای (COL4A۱ (۲q۳۱) ،COL4A۳ (۲q۳۶) ،COL4A۴ (۲q۳۱) ،COL4A5 (Xq۲۲ منجر به سندروم آلپورت میشود.
- در کلاژن نوع V، جهش در ژن (COL5A۱ (۹q۳۴ منجر به بیماری اهلرز دانلوس نوع I میشود.
- در کلاژن نوع VII جهش در ژن (COL7A۱ (۳p۲۱ منجر به بیماری Dystrophic epidermolysis bullosa میشود.
- در کلاژن نوع X جهش در ژن (COL10A۱ (۶p۲۱ منجر به بیماری Schmid Metaphyseal dysplasia میشود.
- در کلاژن نوع XI جهش در ژن (COL11A۲ (۶p۲۱ منجر به سندروم Stickler میشود.
کاربرد کلاژن در مهندسی بافت
کلاژن، پروتئین بستر خارج سلولی، بیشترین استفاده را بین پلیمرهای طبیعی به جهت استفاده در داربستهای پلیمری داراست. پروتئین مذکور به وفور در بافت استخوانی حضور داشته و به سادگی قابل استخراج است. نزدیک به ۳۰٪ از پروتئینهای بدن از نوع کلاژن است. دسترسی آسان به کلاژن و ساختار بی نظیر آن، پژوهشگران را بر آن داشته که جایگاه ویژه ای را به این پلیمر اختصاص دهند. کلاژن سازگاری مناسبی را با سامانه بیولوژیکی انسان دارد و پاسخهای ایمنی آن کاملاً مشابه با بافت میزبان است. کلاژن از بافتهای سالم قابل استخراج است. این پروتئین پس از محلول سازی و تغییر ساختاری، در مهندسی بافت استخوان مورد استفاده قرار میگیرد. استرلیزه کردن و ایجاد اتصالات عرضی از جمله روشهای تثبیت ساختاری کلاژن به حساب میآید. به منظور سترون سازی محصولات کلاژنی، میتوان آنرا در معرض چشمه گاما قرار داد؛ البته لازم است ذکر شود که بعضی مواقع مشاهدات حاکی از پاسخ منفی سامانه ایمنی بدن به عامل ایجاد اتصالات عرضی میباشد.[1]
منابع
- "Biomedical applications of collagen". International Journal of Pharmaceutics. 221 (1–2): 1–22. 2001-06-19. doi:10.1016/S0378-5173(01)00691-3. ISSN 0378-5173.
- آلبرت لنینگر، مایکل کاکس، دیویدلی نلسون، (۱۳۸۵)، اصول بیوشیمی لنینجر، ترجمهٔ رضا محمدی، آییژ، ص. ص٫، شابک ۹۶۴-۸۳۹۷-۰۵-۸
