اختلال عصبی تکوینی
اختلال عصبی تکوینی یک اختلال ذهنی است. یک اختلال روانی است که به اختلالات عملکردی مغز که بر احساس، توانایی یادگیری، خویشتن داری، حافظه و هرچه که در افراد توسعه مییابد، اثر میگذارد مربوط است.
| اختلال عصبی تکاملی | |
|---|---|
| تخصص | روانپزشکی، عصبشناسی |
تعریف
اختلالات عصبی تکوینی[1]، اختلالات مربوط به رشد و توسعه مغز یا دستگاه عصبی مرکزی هستند. یک اختلال روانی است که مربوط است به اختلالات عملکردی مغز که بر احساس، توانایی یادگیری، خویشتن داری، حافظه و هرچه که در افراد توسعه مییابد، اثر میگذارد.
این اصطلاح گاهی به اشتباه به عنوان یک سندروم برای اختلال اوتیسم، در نظر گرفته میشود.
انواع
اختلالاتی به عنوان عصبی تکوینی در نظر گرفته میشود که شامل موارد زیر گردند:
- کم توان ذهنی (ID) و یا فکری و ناتوانی رشدی (IDD)، که پیشتر به عنوان عقب ماندگی ذهنی شناخته میشد
- اختلالات طیف اوتیسم مانند سندرم اسپرگر و یا سندرم کانر
- اختلالت موتوری از جمله اختلالات هماهنگی رشدی و اختلال موتوری
- اختلال تیک از جمله سندرم تورت
- آسیب تروماتیک مغز (از جمله مادرزادی و صدمات مانند آن که باعث فلج مغزی[2] میگردند)
- اختلالات ارتباطی و گفتاری زبانی
- اختلالات ژنتیکی مانند سندرم ایکس شکننده، سندرم داون[3]، اختلال کمتوجهی - بیشفعالی، اسکیزوفرنی، اختلال شخصیت اسکیزوتایپال[4]
- اختلالات ناشی از سمیت عصبی همانند ناهنجاریهای جنینی ناشی از الکل، بیماری میناماتا، اختلالات ناشی از جیوه، اختلالات هیجانی و رفتاری از جمله اختلال سلوک و غیره که ناشی از سایر فلزات سنگین مانند سرب، کروم، پلاتین و غیره میباشند، هیدروکربنها مانند دیوکسین، PBDEs و PCBs از داروها و مواد مخدر مانند کوکائین و دیگر مواد مخدر.
علل
توسعه سیستم عصبی از جمله مغز یک فرایند سازماندهی شده و کدگذاری شده ژنتیکی با تأثیرپذیری مستقیم از طبیعت میباشد. این امر نشان میدهد که هر گونه انحراف از این برنامهریزی در اوایل زندگی میتواند منجر به اختلالات تکوینی و بسته به زمانبندی خاص، ممکن است منجر به تفاوتهای پاتولوژی در سنین بزرگسالی گردد.[5] به همین علت، دلایل بسیاری میتواند منجر به اختلالات عصبی تکوینی گردد، که میتواند طیف وسیعی از محرومیتهای ژنتیکی و بیماری های متابولیک، اختلالات ایمنی بدن، اختلالات عفونی، بیماریهای تغذیهای،عوامل فیزیکی تروما و فاکتورهای سمی و عوامل محیطی را شامل شود.
برخی از اختلالات عصبی—مانند اوتیسم و دیگر اختلالات رشدی فراگیر—سندرمهای چند فاکتوری در نظر گرفته میشوند با علل بسیاری اما بیشتر خاص تکوینی تجلی است.[6]
محرومیت
محرومیت از مراقبتهای اجتماعی و عاطفی باعث تأخیر در رشد مغز و توسعه شناختی میگردد. مطالعات در ارتباط با کودکان در حال رشد یتیمخانههای رومانیایی در طول حکومت نیکلای چائوشسکو اثرات عمیق محرومیت اجتماعی و محرومیت زبانی در مغز در حال توسعه را به خوبی نمایان میسازند. این اثرات وابسته به زمان است. هرچه کودکان بیشتر در معرض سهلانگاریهای مؤسسه مراقبتی قرار میگرفتند، دچار عواقب بیشتری میشدند. در مقابل به سرپرستی گرفته شدن کودکان در سنین پایین باعث کاهش برخی از اثرات زود هنگام اختلالات روانی میگردد. [7]
اختلالات ژنتیکی

نمونه بارزی از یک اختلال عصبی تکوینی ژنتیکی است تریزومی ۲۱ که همچنین به عنوان سندرم داون شناخته شده میباشد،. این اختلال معمولاً در نتیجه یک کروموزوم 21 اضافی است. اگرچه این اختلال در موارد غیر معمول، مربوط به سایر اختلالات کروموزونی مانند انتقال از مواد ژنتیکی است. این سندروم توسط قد کوتاه، چینخوردگی پلک بلند، اثر انگشت غیر طبیعی، مشکلات قلبی، تونوس ماهیچهای ضعیفتر، و عقب ماندگی ذهنی (تاخیر در رشد فکری) مشخص میگردد.
یکی از اختلالات کمتر شناخته شده ژنتیکی تکوینی سندرم X شکننده میباشد. سندرم X شکننده برای اولین بار در سال ۱۹۴۳ توسط جی. پی. مارتین و جی. بل در مطالعه افراد با سابقه خانوادگی روانی "نقص" مرتبط با sex-linked توصیف گردیده است.[8] سندرم رت، یکی دیگر از اختلالات X-linked، سبب محدودیتهای شدید عملکردی میگردد.[9] همچنین نشانگان ویلیامز ناشی از حذف کوچکی از مواد ژنتیکی از کروموزوم 7 میباشد.[10] شایعترین اختلالات تنوع تعداد کپی نشانگان دی جرج پس از سندرم پرادر ویلی و سندرم آنجلمن میباشند.
اختلال در عملکرد سیستم ایمنی
واکنشهای سیستم ایمنی در دوران بارداری، هم در مادر و هم در کودک ممکن است سبب ایجاد اختلالات تکوینی در حال توسعه شوند. یک نمونه واکنش ایمنی بدن در نوزادان و کودکان پانداس میباشد،[11] نمونه دیگر اختلالات نوروپزشکی خود ایمنی اطفال مرتبط با عفونت استرپتوکوکی میباشد.[12] یکی دیگر از اختلالات Sydenham's chorea میباشد که سبب حرکات غیرطبیعی بیشتر بدن میگردد. هر دو مورد ذکر شده واکنشهای ایمنی بدن علیه بافت مغز میباشد که به دنبال عفونت باکتری استرپتوکوک است. شانس ابتلا به این بیماریهای ایمنی احتمالاً به صورت ژنتیکی تعیین میشود[13] بنابراین گاهی اوقات تعدادی از اعضای خانواده ممکن است از یکی یا هر دو اختلال پس از یک بیماری همه گیر از عفونت استرپی رنج ببرند.
بیماری های عفونی
عفونتهای سیستمیک میتواند در نتیجه عواقب عصبی تکوینی زمانی که آنها در دوران نوزادی و کودکی انسان رخ میدهند باشند، اما نمیتواند به عنوان یک اختلال عصبی تکوینی اولیه شناخته شوند، به عنوان مثال HIV[14]، عفونتهای سر و مغز مانند آبسه مغز، مننژیت یا آنسفالیت، شانس بالای رخداد مشکلات تکوینی و در نهایت یک اختلال را دارا هستند.
تعدادی از بیماری های عفونی میتوانند به صورت مادرزادی (قبل و یا در هنگام تولد) منتقل شوند و همچنین میتواند باعث مشکلات تکوینی جدی گردند، به عنوان مثال ویروس HSV ،CMV، سرخچه (سندرم سرخچه مادرزادی)، ویروس زیکا، و یا باکتریهایی در سیفلیس مادرزادی که اگر درمان نشوند ممکن است به عصبی سفلیس پیشرفت کنند. همچنین تک یاخته مانند پلاستمودیوم و یا توکسوپلاسما میتواند باعث توکسوپلاسموز مادرزادی شوند، که با چند کیست در مغز و سایر ارگانها منجر به انواع مشکلات عصبی میگردند.
همچنین برخی از موارد اسکیزوفرنی ممکن است مربوط به عفونت مادرزادی باشند که اکثریت از علل ناشناخته هستند.[15]
اختلالات متابولیک
اختلالات متابولیک چه در مادر و چه در کودک میتواند باعث اختلالات عصبی تکوینی گردند. دو نمونه از این موضوع دیابت (یک اختلال چند عاملی) و فنیل هستند. بسیاری از بیماریها از جمله بیماریهای ارثی ممکن است بهطور مستقیم بر سوخت و ساز بدن و عصبی تکوینی[16] کودک تأثیر بگذارد، اما بهطور معمول کمتر میتوانند به شکل غیرمستقیم در طول بارداری بر کودک تأثیرگذار باشند. (همچنین نگاه کنید تراتوژن).
در یک کودک، ابتلا به دیابت نوع 1 میتواند باعث آسیب توسعه تکوینی در اثر وجود بیش از حد یا ناکافی قند خون باشد. مشکلات ادامه مییابند و ممکن است در طول دوران کودکی وخیمتر شوند اگر دیابت به خوبی کنترل نشود.[17] دیابت نوع 2 ممکن است در ابتدای شروع، با تضعیف اختلال عملکرد شناختی آغاز گردد.[18]
یک جنین غیر دیابتی نیز میتواند در معرض اثرات قند قرار گیرد، اگر مادرش دچار دیابت حاملگی تشخیص داده نشده باشد. دیابت مادری هنگام تولد باعث اندازه بیش از حد نوزاد میشود به طوری که عبور از کانال تولد برای نوزاد بدون آسیب دیدن سخت میباشد، همچنین میتواند بهطور مستقیم سبب نقصهای عصبی تکوینی گردد. معمولاً نشانههای عصبی تکوینی بعد از دوران پس از کودکی کاهش مییابد.[19]
فنیل، که به عنوان PKU نیز شناخته شدهاست، میتواند باعث افزایش احتمال ابتلا به بیماریهای توسعه تکوینی گردد، به همین منظور کودکان مبتلا به PKU نیاز به یک رژیم غذایی سخت برای جلوگیری از عقب ماندگی ذهنی و اختلالات دیگر دارند. در شکل مادرانه PKU، حتی اگر کودک به بیماری PKU مبتلا نشده باشد، در مادر باردار میتواند فنیل آلانین بیش از حد جذب شود . که این میتواند باعث عقب ماندگی ذهنی و اختلالات دیگر شود.[20][21]
تغذیه
اختلالات تغذیه ای و کمبود تغذیهای ممکن است باعث اختلالات عصبی مانند اسپینا بیفیدا و به ندرت باعث آنانسفالی گردد، که هر دو نقصهای لوله عصبی با ناهنجاری و اختلال در عملکرد سیستم عصبی هستند و ساختار آنها منجر به ناتوانی جدی جسمی و عوارض عاطفی میگردد. شایعترین تغذیهای که باعث نقص لوله عصبی میشود، کمبود اسید فولیک در مادر میباشد، ویتامین ب معمولاً در میوهها و سبزیجات و غلات کامل و محصولات لبنی یافت میشود.[22][23] (نقص لوله عصبی همچنین ناشی از داروها و دیگر دلایل زیستمحیطی میباشد که بسیاری از آنها در متابولیسم فولات مداخله میکنند و در نتیجه در نظر گرفته میشود که آنها دارای دلایل چند عاملی میباشند.)[24][25] یکی دیگر از کمبودها، کمبود ید میباشد، که باعث یک طیف از اختلالات تکوینی اعم از خفیف عاطفی تا اختلال شدید عقب ماندگی ذهنی میشود. (همچنین نگاه کنید به کرتینیسم)
افراط در رژیم غذایی هم مادر و هم نوزاد ممکن است باعث بیماریهای ناشی از مواد غذایی و یا مکملهای غذایی سمی در مقادیر زیاد گردد. به عنوان مثال در سال 1973 کی. ال. جونز و دی. دبلیو. اسمیت از دانشگاه واشنگتن در دانشکده پزشکی در سیاتل به الگویی از ارتباط نقصهای قلبی و عروقی و کمبود رشد در دوران بارداری در فرزندان مادران الکلی که در حال حاضر به نام ناهنجاریهای جنینی ناشی از الکل شناخته میشود دست یافتند که علائم همپوشانی قابل توجهی با دیگر اختلالات توسعه تکوینی نامربوط دارند.[26] همچنین دیده شدهاست که مصرف مکمل آهن در شیر خشک میتواند منجر به کاهش ضریب هوشی و دیگر تاخیرات عصبی تکوینی گردد.[27]
ضربه فیزیکی
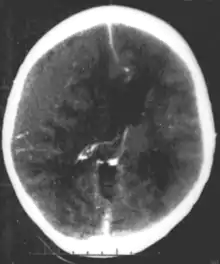
ضربه مغزی در انسان حال توسعه یکی از علتهای شایع (بیش از چهارصد هزار مصدوم در هر سال به تنهایی در ایالات متحده)[28] از سندرمهای عصبی تکوینی میباشد. که آن را به دو دسته عمده تقسیمبندی میکنند، آسیب مادرزادی (از جمله آسیب ناشی از نارسایی زودرس هنگام تولد) و یا آسیب دیدن در دوران کودکی. علل شایع آسیب مادرزادی آسفیکسی (انسداد نای), هیپوکسی (کمبود اکسیژن به مغز) و تروما ناشی از فرایند تولد هستند.
تشخیص
بهطور سنتی، ناهنجاریهای ژنتیکی در اختلالات عصبی تکوینی تشخیص با استفاده از تجزیه و تحلیل کاریوتایپ که ۵٪ اختلالات مرتبط را تشخیص میدهد شناسایی شدهاست. تا تاریخ ۲۰۱۷ به دلیل عملکرد تشخیصی بهتر، در حدود ۲۰ درصد از موارد، و تشخیص کوچکتر ناهنجاریهای کروموزومی، تجزیه و تحلیل ریزآرایهای کروموزومی (CMA) جایگزین کاریوتایپ شدهاست.
با CMA هزینههای از $800 ایالات متحده به $1500 آزمایش افزایش یافتهاست. همچنین در دستورالعمل کالج آمریکایی پزشکی ژنتیک و ژنومیک و آکادمی اطفال آمریکا، CMA به عنوان استاندارد مراقبت در ایالات متحده توصیه شدهاست.
عوارض
در بسیاری از اختلالات تکوینی عصبی بسته به درجات مختلف آنها، عواقب ذهنی، عاطفی، جسمی و اقتصادی برای فرد مبتلا به وجود میآید و به نوبه خود خانواده، گروههای اجتماعی و جامعه را نیز درگیر میکند.
جستارهای وابسته
Microcephaly Reverse learning
Teratologyکتابشناسی
- Tager-Flusberg, Helen (1999). Neurodevelopmental disorders. Cambridge, Massachusetts: MIT Press. ISBN 0-262-20116-X.
- Brooks, David R.; Walter Wolfgang Fleischhacker (2006). Neurodevelopmental Disorders. Berlin: Springer. ISBN 3-211-26291-1.
یادداشت
- Reynolds, Cecil R.; Goldstein, Sam (1999). Handbook of neurodevelopmental and genetic disorders in children. New York: The Guilford Press. pp. 3–8. ISBN 1-57230-448-0.
- Murray RM, Lewis SW (September 1987). "Is schizophrenia a neurodevelopmental disorder?". Br Med J (Clin Res Ed). 295 (6600): 681–2. doi:10.1136/bmj.295.6600.681. PMC 1247717. PMID 3117295.
- Facts about down syndrome بایگانیشده در ۲۰۱۲-۰۴-۰۳ توسط Wayback Machine
- Hernan Valdes-Socin, Matilde Rubio Almanza, Mariana Tomé Fernández-Ladreda, et al. Reproduction, smell, and neurodevelopmental disorders: genetic defects in different hypogonadotropic hypogonadal syndromes. Frontiers in Endocrinology 2014, 5: 109. review
- Pletikos, Mihovil; Sousa, Andre MM; et al. (22 January 2014). "Temporal Specification and Bilaterality of Human Neocortical Topographic Gene Expression". Neuron. 81 (2): 321–332. doi:10.1016/j.neuron.2013.11.018. PMC 3931000. PMID 24373884.
- Samaco RC, Hogart A, LaSalle JM (February 2005). "Epigenetic overlap in autism-spectrum neurodevelopmental disorders: MECP2 deficiency causes reduced expression of UBE3A and GABRB3". Hum. Mol. Genet. 14 (4): 483–92. doi:10.1093/hmg/ddi045. PMC 1224722. PMID 15615769.
- Nelson C.A.; et al. (2007). "Cognitive Recovery in Socially Deprived Young Children: The Bucharest Early Intervention Project". Science.
- Martin JP, Bell J (1943). "A pedigree of mental defect showing sex-linkage". J. Neurol. Psychiat. 6 (3–4): 154–7. doi:10.1136/jnnp.6.3-4.154. PMC 1090429. PMID 21611430.
- Amir RE, Van den Veyver IB, Wan M, Tran CQ, Francke U, Zoghbi HY (October 1999). "Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2". Nat. Genet. 23 (2): 185–8. doi:10.1038/13810. PMID 10508514.
- Merla G, Howald C, Henrichsen CN, et al. (August 2006). "Submicroscopic Deletion in Patients with Williams-Beuren Syndrome Influences Expression Levels of the Nonhemizygous Flanking Genes". Am. J. Hum. Genet. 79 (2): 332–41. doi:10.1086/506371. PMC 1559497. PMID 16826523.
- Pavone, P.; et al. (2004). "Anti-brain antibodies in PANDAS versus uncomplicated streptococcal infection". Pediatr Neurol. 30 (2): 107–110. doi:10.1016/S0887-8994(03)00413-2. PMID 14984902.
- Dale, RC.; et al. (2005). "Incidence of anti-brain antibodies in children with obsessive–compulsive disorder". Br J Psychiatry. 187 (4): 314–319. doi:10.1192/bjp.187.4.314. PMID 16199788. Retrieved 2008-08-17.
- Swedo, Susan E (December 2001). "Genetics of childhood disorders: XXXIII autoimmunity part 6: poststreptoccoal autoimmunity". Reprinted from J Am Acad Child Adolesc Psychiatry, 40:12,1479-1482. Retrieved 2008-08-17.
- Bolvin, MJ; Kakooza, AM; Warf, BC; Davidson, LL; Grigorenko, EL (November 2015). "Reducing neurodevelopmental disorders and disability through research and interventions". Nature. 527 (7578): S155–60. doi:10.1038/nature16029. PMID 26580321.
- "Prenatal infection as a risk factor for schizophrenia – Brown 32 (2): 200 – Schizophrenia Bulletin". Retrieved 2008-08-10.
- Richardson, A.J.; Ross, M.A. (July 2000). "Fatty acid metabolism in neurodevelopmental disorder: a new perspective on associations between attention-deficit/hyperactivity disorder, dyslexia, dyspraxia, and the autistic spectrum". Prostaglandins, Leukotrienes and Essential Fatty Acids. 63 (1–2): 1–9. doi:10.1054/plef.2000.0184. PMID 10970706.
- Nordham, Elizabeth A; Anderson, PJ; Jacobs, R; Hughes, M; Warne, GL; Werther, GA; et al. (2001). "Neuropsychological Profiles of Children With Type 1 Diabetes 6 Years After Disease Onset". Diabetes Care. 24 (9): 1541–1546. doi:10.2337/diacare.24.9.1541. PMID 11522696.
- Olsson, Gunilla M.; Hulting, AL; Montgomery, SM; et al. (2008). "Cognitive Function in Children and Subsequent Type 2 Diabetes: Response to Batty, Gale, and Deary". Diabetes Care. 31 (3): 514–516. doi:10.2337/dc07-1399. PMC 2453642. PMID 18083794.
- Ornoy A, Wolf A, Ratzon N, Greenbaum C, Dulitzky M (July 1999). "Neurodevelopmental outcome at early school age of children born to mothers with gestational diabetes". Arch. Dis. Child. Fetal Neonatal Ed. 81 (1): F10–4. PMC 1720965. PMID 10375355.
- Lee PJ, Ridout D, Walter JH, Cockburn F (February 2005). "Maternal phenylketonuria: report from the United Kingdom Registry 1978-97". Arch. Dis. Child. 90 (2): 143–6. doi:10.1136/adc.2003.037762. PMC 1720245. PMID 15665165.
- Rouse B, Azen C, Koch R, et al. (March 1997). "Maternal Phenylketonuria Collaborative Study (MPKUCS) offspring: facial anomalies, malformations, and early neurological sequelae". Am. J. Med. Genet. 69 (1): 89–95. doi:10.1002/(SICI)1096-8628(19970303)69:1<89::AID-AJMG17>3.0.CO;2-K. PMID 9066890.
- "Folic Acid - March of Dimes".
- "Folate (Folacin, Folic Acid)".
- "Folic scid: topic home". Centers for Disease Control and Prevention. U.S. Department of Health and Human Services. Retrieved 2008-08-02.
- "The basics about spina bifida". Centers for Disease Control and Prevention. U.S. Department of Health and Human Services. Retrieved 2008-08-02.
- Fetal alcohol syndrome: guidelines for referral and diagnosis (PDF). بایگانیشده در ۲۳ آوریل ۲۰۰۹ توسط Wayback Machine CDC (July 2004). Retrieved on 2007-04-11
- Kerr, Martha; Désirée Lie (2008). "Neurodevelopmental delays associated with iron-fortified formula for healthy infants". Medscape Psychiatry and Mental Health. Retrieved 2008-08-04.
- "Facts About TBI" (PDF). Retrieved 2008-08-06.