سکته قلبی
سکته قلبی (Myocardial infarction) که به آن آنفارکتوس میوکارد نیز میگویند، هنگامی اتفاق میافتد که جریان خون در بخشی از قلب کاهش یافته یا متوقف شود و باعث آسیب به عضله قلب شود.[1] شایعترین علامت درد یا ناراحتی قفسه سینه است که ممکن است به شانه، بازو، کمر، گردن یا فک تیر بکشد.[1] غالباً در مرکز یا سمت چپ قفسه سینه رخ میدهد و بیش از چند دقیقه طول میکشد.[1] ناراحتی ممکن است گاهی مانند معده درد شود.[1] علائم دیگر ممکن است شامل تنگی نفس، حالت تهوع، احساس ضعف، عرق سرد یا احساس خستگی باشد.[1] حدود ۳۰٪ افراد علائم غیرمعمول دارند.[1][8] در زنان گاهی درد قفسه سینه ظاهر نمیشود و در عوض درد گردن، درد بازو دارند یا احساس خستگی میکنند.[11] در میان افراد بالای ۷۵ سال، در حدود ۵٪ افرادی که دچار MI شدهاند، علائم اندک بوده یا اصلاً وجود نداشتهاست.[12] MI ممکن است باعث نارسایی قلبی، ضربان قلب نامنظم، شوک قلبی یا ایست قلبی شود.[3][4]
| آنفارکتوس میوکارد | |
|---|---|
| دیگر نامها | ام آی حاد، حمله قلبی |
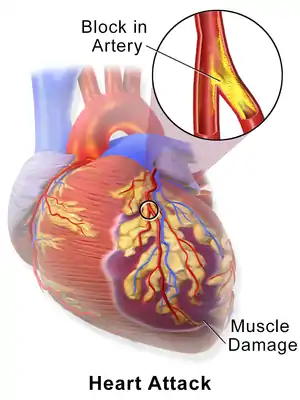 | |
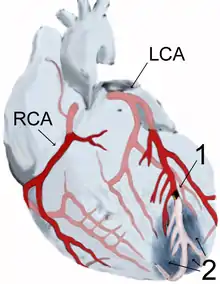
| سکته قلبی زمانی اتفاق میافتد که پلاک آترواسکلروتیک به آهستگی در پوشش داخلی شریان کرونر جمع شده و سپس بهطور ناگهانی پاره شود و باعث ایجاد فاجعهٔ ترومبوس، انسداد کامل عروق و مانع از رسیدن جریان خون به پایین دست شود. | |
| تخصص | تخصص قلب، طب اورژانس |
| علامتها | درد قفسه سینه، تنگی نفس، تهوع، پیش سنکوپ، تعریق سرد، احساس خستگی؛ درد در ناحیهٔ گردن، فک، پشت، بازو و معده[1][2] |
| عوارض | نارسایی قلبی، اختلال در ضربان قلب یا همان آریتمی، شوک قلبی، ایست قلبی[3][4] |
| علت | معمولاً بیماری عروق کرونر[3] |
| عامل خطر | فشار خون بالا، مصرف دخانیات، دیابت شیرین، کمتحرکی، چاقی، چربی خون بالا[5][6] |
| تشخیص پزشکی | نوار قلب، blood tests, آنژیوگرافی کرونر[7] |
| درمان | مداخله در عروق کرونر از راه پوست، ترمبولیز (باز کردن لخته با دارو)[8] |
| دارو | آسپیرین، داروی نیتروگلیسیرین، هپارین[8][9] |
| پیشآگهی | ۱۰ درصد خطر مرگ برای STEMI در کشورهای توسعه یافته[8] |
| فراوانی | ۱۵٫۹ میلیون در سال ۲۰۱۵[10] |
بیشتر MIها به دلیل بیماری عروق کرونر رخ میدهند.[3] عوامل خطر شامل فشار خون بالا، استعمال دخانیات، دیابت، عدم ورزش، چاقی، کلسترول خون بالا، رژیم غذایی نامناسب و مصرف بیش از حد الکل است.[5][6] انسداد کامل عروق کرونر ناشی از پارگی پلاک آترواسکلروتیک معمولاً مکانیسم اساسی MI است.[3] سکته قلبی بهطور کمتر شایع، به علت اسپاسم عروق کرونر اتفاق میافتد، که ممکن است به دلیل کوکائین، استرس عاطفی قابل توجه (معروف به سندرم تاکوتسوبو یا سندرم قلب شکسته) و سرماخوردگی شدید باشد.[13][14] تعدادی آزمایش برای کمک به تشخیص مفید است، از جمله الکتروکاردیوگرام (نوار قلب)، آزمایش خون و آنژیوگرافی کرونر.[7] نوار قلب (ECG)، که ثبت کننده فعالیت الکتریکی قلب است، در صورت وجود ارتفاع ST، ممکن است STEMI را تأیید کند.[8][15] آزمایش خون معمولاً شامل تروپونین و کمتر کراتین کیناز نوع MB است.[7]
درمان فوری MI حیاتی است.[16] آسپرین یک درمان فوری مناسب برای افراد مشکوک به MI است.[9] نیتروگلیسیرین یا مواد مخدر ممکن است برای کمک به درد قفسه سینه استفاده شود. با این حال، آنها نتایج کلی را بهبود نمیبخشند.[8][9] اکسیژن اضافی در افرادی که سطح اکسیژن کم یا تنگی نفس دارند توصیه میشود.[9] در STEMI، درمانهایی که میتوانند جریان خون را به قلب بازگردانند، شامل مداخله در عروق کرونر از راه پوست (PCI) هستند، جایی که رگها تحت فشار باز میشوند و ممکن است استنت شوند، یا ترومبولیز، جایی که انسداد با استفاده از داروها برطرف میشود.[8] افرادی که دچار سکته قلبی غیر STEMI هستند (NSTEMI) اغلب با هپارین که رقیق کننده خون است درمان میشوند، به اضافه PCI در افراد در معرض خطر.[9] در افراد مبتلا به انسداد شرایین متعدد کرونر و دیابت، ممکن است جراحی بای پس شریان کرونر (CABG) به جای آنژیوپلاستی توصیه شود.[17] پس از سکته قلبی، بهطور معمول اصلاح سبک زندگی، همراه با درمان طولانی مدت با آسپیرین، بتا بلاکرها و استاتینها توصیه میشود.[8]
در سراسر جهان، در حدود ۱۵٫۹ میلیون سکته قلبی در سال ۲۰۱۵ رخ دادهاست.[10] بیش از ۳ میلیون نفر دارای STEMI و بیش از ۴ میلیون نفر دارای NSTEMI بودند. [18] STEMI تقریباً در مردان دو برابر زنان رخ میدهد.[18][19] سالانه حدود یک میلیون نفر دچار MI میشوند.[3] در کشورهای پیشرفته، خطر مرگ در کسانی که STEMI داشتهاند حدود ۱۰٪ است.[8] میزان MI برای یک سن مشخص بین سالهای ۱۹۹۰ و ۲۰۱۰ در سطح جهانی کاهش یافتهاست.[20] در سال ۲۰۱۱، MI با هزینه ای در حدود ۱۱٫۵ میلیارد دلار برای ۶۱۲٬۰۰۰ بستری در بیمارستان، یکی از پنج بیماری پرهزینه در طی بستری شدن در بیمارستان در ایالات متحده بود.[21]
لغتشناسی
سکته قلبی (MI) به مرگ بافتی (آنفارکتوس) عضله قلب (میوکارد) ناشی از ایسکمی، یعنی کمبود اکسیژن رسانی به بافت میوکارد اشاره دارد. این نوعی سندرم حاد کرونری مربوط به تغییر ناگهانی یا کوتاه مدت علائم ناشی از تغییر جریان خون در قلب است. [22] برخلاف نوع دیگر سندرم کرونری حاد، آنژین ناپایدار، سکته قلبی در صورت مرگ سلولی رخ میدهد، این را میتوان با اندازهگیری آزمایش خون برای نشانگرهای زیستی (پروتئین قلبی تروپونین) تخمین زد. [23] هنگامی که شواهدی از MI وجود دارد، ممکن است آن را به عنوان سکته قلبی قلبی STEMI یا سکته قلبی NSTEMI بر اساس نتایج ECG طبقهبندی کنند.[24]
اصطلاح «حمله قلبی» اغلب بهطور غیر اختصاصی برای اشاره به سکته قلبی استفاده میشود. سکته قلبی با ایست قلبی فرق میکند - اما میتواند باعث ایست قلبی شود، در ایست قلبی قلب منقبض نمیشود یا به حدی ضعیف پمپاژ میکند که تمام اندامهای حیاتی دیگر کار نمیکنند، بنابراین ممکن است منجر به مرگ شود. [25] همچنین با نارسایی قلبی، که در آن عمل پمپاژ قلب مختل میشود، فرق دارد. با این حال، MI میتواند منجر به نارسایی قلبی شود.[26]
علائم و نشانهها
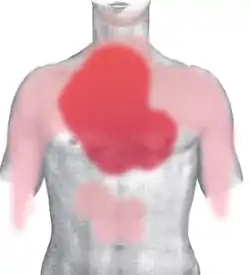
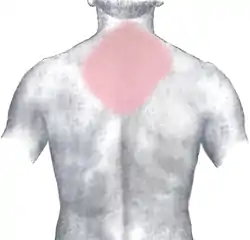
درد قفسه سینه که ممکن است به سایر قسمتهای بدن تیر بکشد یا نکشد، معمولترین و قابل توجهترین علامت سکته قلبی است. ممکن است با علائم دیگری مانند تعریق همراه باشد. [27]
درد
درد قفسه سینه رایجترین علامت سکته قلبی حاد است و اغلب به عنوان احساس گرفتگی، یا فشار توصیف میشود. درد اغلب به بازوی چپ انتشار پیدا میکند، اما ممکن است به فک پایین، گردن، بازوی راست، پشت و بالای شکم نیز منتشر شود.[28][29] دردی که بیشترین میزان MI حاد را نشان میدهد، با بیشترین نسبت احتمال، درد ناشی از بازو و شانه راست است.[30][29] بهطور مشابه، درد قفسه سینه مشابه حمله قلبی قبلی نیز مهم است.[31] درد همراه با MI معمولاً منتشر است، با تغییر وضعیت تغییر نمیکند و بیش از ۲۰ دقیقه طول میکشد.[24] این ممکن است به عنوان فشار، احساس تنگی قفسه سینه، مانند چاقو، پارگی، احساس سوزش توصیف شود (همه اینها در طی بیماریهای دیگر نیز بروز میکند). این میتواند به عنوان یک اضطراب غیرقابل توضیح احساس شود، یا حتی ممکن است درد اصلاً وجود نداشته باشد. [29] علامت لوین، که در آن فرد درد قفسه سینه را با فشار دادن یکی از دو مشت بر روی جناغ خود، تعیین محل میکند، بهطور کلاسیک تصور میشد که پیشبینی کننده درد قلبی قفسه سینه است، اگرچه یک مطالعه مشاهده ای آینده نگر نشان میدهد که از ارزش پیشبینی مثبت ضعیفی برخوردار است.[32]
بهطور معمول، درد قفسه سینه ناشی از ایسکمی، آنژین ناپایدار یا سکته قلبی، با استفاده از نیتروگلیسیرین کاهش مییابد، اما نیتروگلیسیرین همچنین ممکن است درد قفسه سینه ناشی از دلایل غیر قلبی را نیز تسکین دهد. [33]
علائم همراه
درد قفسه سینه ممکن است با تعریق، حالت تهوع یا استفراغ و غش (سنکوپ) همراه باشد[24][30] و این علائم نیز ممکن است بدون هیچ گونه دردی بروز کند.[28] در زنان، شایعترین علائم سکته قلبی شامل تنگی نفس، ضعف و خستگی است.[34] تنگی نفس یک علامت رایج است و گاهی اوقات تنها علامت است و زمانی بوجود میآید که آسیب به قلب باعث کاهش جریان خون خروجی بطن چپ میشود. در این حالت، تنگی نفس یا ناشی از اکسیژن کم خون یا ادم ریوی است.[28][35] علائم دیگر کمتر شایع عبارتند از ضعف، سبکی سر، تپش قلب و اختلال در ضربان قلب یا فشار خون.[16] این علائم احتمالاً در اثر افزایش شدید کاتکول آمینها از سیستم عصبی سمپاتیک ایجاد میشود که در پاسخ به درد و در صورت وجود فشار خون پایین رخ میدهد.[36] از دست دادن هوشیاری به دلیل جریان ناکافی خون در مغز و شوک قلبی، و مرگ ناگهانی، غالباً به دلیل ایجاد فیبریلاسیون بطنی، میتواند در سکتههای قلبی رخ دهد.[37] ایست قلبی و علائم غیرطبیعی مانند تپش قلب، بیشتر در زنان، افراد مسن، مبتلایان به دیابت، در افرادی که به تازگی جراحی شدهاند و در بیماران بسیار بدحال اتفاق میافتد.[24]
سکته خاموش
سکتههای قلبی «خاموش» میتوانند بدون هیچ علائمی اتفاق بیفتند.[12] این موارد را میتوان بعداً در الکتروکاردیوگرام، با استفاده از آزمایشات آنزیم خون یا در کالبد شکافی پس از مرگ شخص کشف کرد. چنین سکتههای خفیف میوکارد بین ۲۲ تا ۶۴ درصد از سکتههای قلبی را تشکیل میدهد،[12] و در افراد مسن،[12] در کسانی که دیابت شیرین دارند[16] و بعد از پیوند قلب بیشتر دیده میشود. در افراد دیابتی، تفاوت در آستانه درد، نوروپاتی اتونوم و عوامل روانشناختی به عنوان دلیل احتمالی برای فقدان علائم ذکر شدهاست.[38] در پیوند قلب، قلب اهدایی بهطور کامل توسط سیستم عصبی گیرنده عصب دهی نمیشود.[39]
عوامل خطر
برجستهترین فاکتورهای خطر سکته قلبی: سن بالاتر، سیگار کشیدن فعال، فشار خون بالا، دیابت شیرین و کلسترول تام و سطح لیپوپروتئین با چگالی بالا(HDL) است. [40] بسیاری از عوامل خطر سکته قلبی با بیماری عروق کرونر که علت اصلی سکته قلبی است، مشترک است.[16] سایر عوامل خطر عبارتند از جنسیت مرد، سطح پایین فعالیت بدنی، سابقه خانوادگی گذشته، چاقی و مصرف الکل.[16] عوامل خطر برای بیماری میوکارد اغلب در نمرات طبقهبندی فاکتورهای خطر مانند نمره خطر Framingham لحاظ میشوند.[19] در هر سن خاص، مردان بیش از زنان در معرض ابتلا به بیماریهای قلبی عروقی هستند.[41] سطح بالای کلسترول خون یک عامل خطر شناخته شدهاست، به ویژه لیپوپروتئین با چگالی کم(LDL) اگر بالا باشد، لیپوپروتئین با چگالی بالا(HDL) اگر پایین باشد و تری گلیسیرید بالا.[42]
بسیاری از عوامل خطر سکته قلبی بهطور بالقوه قابل تغییر هستند که مهمترین آنها سیگار کشیدن (از جمله دود سیگار) است.[16] به نظر میرسد سیگار کشیدن علت حدود ۳۶٪ و چاقی علت ۲۰٪ بیماری عروق کرونر باشد.[43] کمبود فعالیت بدنی به ۷–۱۲ درصد موارد مربوط میشود.[43][44] علل کمتر شایع شامل علل مرتبط با استرس مانند استرس شغلی است که حدود ۳٪ موارد را تشکیل میدهد،[43] و سطح استرس شدید مزمن.[45]
رژیم غذایی
شواهد مختلفی در مورد اهمیت چربی اشباع در ایجاد سکتههای قلبی وجود دارد. در مطالعات نشان دادهاست که خوردن چربی polyunsaturated به جای چربی اشباع با کاهش خطر سکته قلبی همراه است،[46] در حالی که مطالعات دیگر شواهد کمی در مورد تأثیر کاهش چربی اشباع شده در رژیم غذایی یا افزایش مصرف چربی polyunsaturated در رژیم غذایی بر خطر حمله قلبی نشان میدهد.[47][48] به نظر نمیرسد که کلسترول غذایی تأثیر قابل توجهی بر کلسترول خون داشته باشد و بنابراین ممکن است نیازی به توصیه در مورد مصرف آن نباشد.[49] به نظر میرسد چربیهای ترانس خطر را افزایش میدهند.[47] مصرف حاد و طولانی مدت مقادیر زیادی نوشیدنیهای الکلی (۳–۴ یا بیشتر در روز) خطر حمله قلبی را افزایش میدهد.[50]
ژنتیک
سابقه خانوادگی بیماری ایسکمیک قلب یا سکته قلبی، به خصوص اگر فرد دارای یک فامیل درجه یک مرد (پدر، برادر) باشد که قبل از ۵۵ سالگی یا یک زن از بستگان درجه یک (مادر، خواهر) که قبل از ۶۵ سالگی سکته قلبی داشته باشد، خطر ابتلا به MI را افزایش میدهد.[41]
سازوکار
تصلب شرایین (آتروسکلروز)
شایعترین علت سکته قلبی، پارگی پلاک آترواسکلروتیک در شریان تأمین کننده عضله قلب است.[37][51] پلاکها میتوانند ناپایدار شوند، پاره شوند و علاوه بر این باعث ایجاد لخته خون شود که شریان را مسدود میکند. این واقعه میتواند در عرض چند دقیقه رخ دهد. انسداد شریان میتواند منجر به مرگ بافتی شود که از طریق آن شریان خونرسانی میشود.[52] پلاکهای آترواسکلروتیک اغلب قبل از بروز علائم، طی دههها وجود دارند.[52]
تجمع تدریجی کلسترول و بافت الیافی در پلاکهای دیواره عروق کرونر یا عروق دیگر، که بهطور معمول طی دههها رخ میدهد، تصلب شرایین نامیده میشود.[53] آترواسکلروز با التهاب پیشرونده دیواره رگها مشخص میشود.[52] سلولهای التهابی، به ویژه ماکروفاژها، به دیوارههای شریانی آسیب دیده منتقل میشوند. با گذشت زمان، آنها مملو از محصولات کلسترول، به ویژه LDL میشوند و به سلولهای کف آلود تبدیل میشوند. هسته کلسترول با مرگ سلولهای کف آلود تشکیل میشود. در پاسخ به فاکتورهای رشد ترشح شده توسط ماکروفاژها، عضله صاف و سلولهای دیگر به داخل پلاک حرکت کرده و برای تثبیت آن عمل میکنند. یک پلاک پایدار ممکن است دارای پوشش الیافی ضخیم همراه با کلسیفیکاسیون باشد. اگر التهاب مداوم وجود داشته باشد، ممکن است پوشش نازک یا زخمی باشد. پلاکها، به ویژه آنهایی که دارای پوشش نازک هستند، در معرض فشار جریان خون، ممکن است پاره شوند و باعث تشکیل لخته خون (ترومبوس) شوند.[52] بلورهای کلسترول با پارگی پلاک از طریق آسیب مکانیکی و التهاب همراه بودهاند.[54]
مرگ بافت
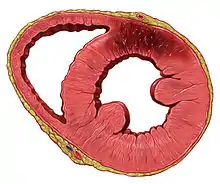
اگر اختلال در جریان خون در قلب به اندازه کافی طولانی باشد، فرایندی به نام آبشار ایسکمیک را آغاز میکند. سلولهای قلب در محدوده انسداد شریان کرونر، عمدتاً از طریق نکروز میمیرند و دوباره رشد نمیکنند. جای زخم کلاژن ایجاد میشود.[52] هنگامی که یک شریان مسدود میشود، سلولها اکسیژن لازم برای تولید ATP در میتوکندری را ندارند. ATP برای حفظ تعادل الکترولیت، به ویژه از طریق Na / K ATPase مورد نیاز است. این منجر به آبشار ایسکمیک تغییرات داخل سلولی، نکروز و آپوپتوز سلولهای آسیب دیده میشود.[55]
سلولهای منطقه با کمترین جریان خون، درست در زیر سطح داخلی قلب (آندوکاردیوم)، بیشتر در معرض آسیب قرار دارند.[56] ایسکمی ابتدا این ناحیه، یعنی ناحیه subendocardial را تحت تأثیر قرار میدهد و بافت در طی ۱۵–۳۰ دقیقه از قطع خونرسانی شروع به مردن میکند.[57] بافت مرده توسط منطقه ای از ایسکمی بالقوه برگشتپذیر احاطه شدهاست که پیشرفت میکند تا به یک آنفارکتوس تمام جداری با ضخامت کامل تبدیل شود.[55][57] «موج» اولیه انفارکت میتواند در طی ۳–۴ ساعت اتفاق بیفتد.[52][55] این تغییرات در آسیبشناسی ماکروسکوپی مشاهده میشود و با وجود یا عدم وجود امواج Q بر روی نوار قلب قابل پیشبینی نیست.[56] موقعیت، اندازه و میزان آنفارکتوس به شریان آسیب دیده، انسداد کامل یا ناکامل، مدت انسداد، وجود رگهای خونی جانبی، نیاز اکسیژن و موفقیت روشهای مداخله ای بستگی دارد.[28][51]
مرگ بافتی و اسکار میوکارد مسیرهای هدایت طبیعی قلب را تغییر داده و مناطق آسیب دیده را ضعیف میکند. اندازه و موقعیت مکانی، فرد را در معرض خطر ریتم غیرطبیعی قلب (آریتمی) یا انسداد کامل سیستم هدایتی قلب، آنوریسم بطنهای قلب، التهاب دیواره قلب به دنبال آنفارکتوس و پارگی دیواره قلب قرار میدهد که میتواند عواقب فاجعه بار داشته باشد.[51][58]
آسیب به میوکارد در هنگام پرفیوژن مجدد نیز اتفاق میافتد. این عارضه ممکن است به صورت آریتمی بطنی ظاهر شود. آسیب ناشی از پرفیوژن مجدد، نتیجه جذب کلسیم و سدیم از سلولهای قلبی و آزاد شدن رادیکالهای اکسیژن در طی پرفیوژن مجدد است. پدیده عدم بازگشت مجدد - وقتی خون علیرغم از بین بردن انسداد، هنوز قادر به توزیع در میوکارد آسیب دیده نیست - نیز به آسیب میوکارد کمک میکند. تورم موضعی اندوتلیال یکی از عوامل مؤثر در بروز این پدیده است.[59]
تشخیص
معیارها
سکته قلبی، طبق اجماع کنونی، توسط نشانگرهای زیستی قلبی با روند صعودی یا نزولی و حداقل یکی از موارد زیر تعریف میشود:[60]
- علائم مربوط به ایسکمی
- تغییرات الکتروکاردیوگرام (ECG)، مانند تغییرات قطعه ST، بلوک شاخه چپ جدید، یا امواج Q پاتولوژیک
- تغییرات در حرکت دیواره قلب در تصویربرداری
- نمایش ترومبوس در آنژیوگرام یا در کالبد شکافی.
انواع
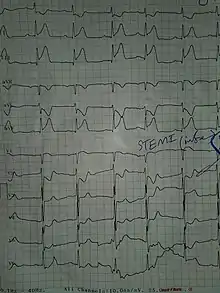
آنفارکتوس میوکارد بهطور کلی از نظر بالینی به ST-elevation MI (STEMI) و non-ST elevation MI (NSTEMI) طبقهبندی میشود. اینها بر اساس تغییرات ECG است.[24] STEMIها حدود ۲۵–۴۰٪ از سکتههای قلبی را تشکیل میدهند.[19] یک سیستم طبقهبندی صریح تر، بر اساس اجماع بینالمللی در سال ۲۰۱۲، نیز وجود دارد که سکتههای قلبی را به پنج نوع طبقهبندی میکند:[24]
- ام آی خود به خودی مربوط به فرسایش پلاک و/ یا شکاف یا پارگی
- ام آی مربوط به ایسکمی، مانند افزایش نیاز به اکسیژن یا کاهش عرضهٔ اکسیژن، به عنوان مثال اسپاسم عروق کرونر، آمبولی کرونر، کم خونی، آریتمی، فشار خون بالا یا فشار خون پایین
- مرگ ناگهانی قلبی غیرقابل پیشبینی، از جمله ایست قلبی، جایی که علائم ممکن است نشان دهنده MI باشد، ECG ممکن است با تغییرات احتمالی گرفته شود، یا لخته شدن خون در شریان کرونر توسط آنژیوگرافی یا در کالبد شکافی دیده شود، اما نمونههای خون قابل دستیابی نیست، یا در زمانی قبل از ظهور نشانگرهای زیستی قلب در خون گرفته شود.
- مرتبط با آنژیوپلاستی کرونر یا استنت
- مرتبط با مداخله کرونر از راه پوست (PCI)
- مرتبط با ترومبوز استنت که توسط آنژیوگرافی یا کالبد شکافی مستند شدهاست
- مرتبط با CABG
- در ارتباط با دایسکشن خود به خودی عروق کرونر در زنان جوان و سالم
نشانگرهای زیستی قلب
تعدادی از نشانگرهای زیستی مختلف برای تعیین وجود آسیب عضلات قلب وجود دارد. تروپونینها که از طریق آزمایش خون اندازهگیری میشوند، بهترین محسوب میشوند[19] و ارجح هستند، زیرا حساسیت و اختصاصیت بیشتری برای اندازهگیری آسیب به عضله قلب نسبت به سایر آزمایشات دارند.[51] افزایش تروپونین طی ۲–۳ ساعت پس از آسیب به عضله قلب رخ میدهد و طی ۱–۲ روز به اوج خود میرسد. سطح تروپونین و همچنین تغییر در طول زمان در اندازهگیری و تشخیص یا رد کردن سکتههای قلبی مفید است و دقت تشخیصی آزمایش تروپونین با گذشت زمان بهبود مییابد.[51] یک تروپونین قلب با حساسیت بالا قادر است حمله قلبی را تا زمانی که نوار قلب طبیعی باشد رد کند.[61][62]
آزمایشهای دیگر، مانند CK-MB یا میوگلوبین، توصیه نمیشوند.[63] CK-MB به اندازه تروپونینها برای آسیب حاد میوکارد اختصاصی نیست و ممکن است با جراحی قلب قبلی، التهاب یا کاردیوورژن الکتریکی افزایش یابد. در عرض ۴–۸ ساعت افزایش مییابد و در طی ۲–۳ روز به حالت طبیعی برمی گردد.[28]
نوار قلب
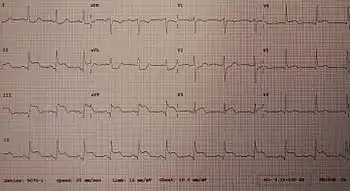
نوار قلب (ECG) مجموعه ای از لیدها است که بر روی قفسه سینه فرد قرار میگیرد و فعالیت الکتریکی مرتبط با انقباض عضله قلب را اندازهگیری میکند.[16] گرفتن نوار قلب بخش مهمی در روند تشخیص AMI است،[24] و نوار قلب اغلب فقط یک بار گرفته نمیشود بلکه ممکن است در عرض چند دقیقه تا چند ساعت تکرار شود، یا در پاسخ به تغییر علائم یا نشانهها گرفته شود.[24]
علاوه بر افزایش نشانگرهای زیستی، افزایش قطعه ST، تغییر شکل یا واژگونی امواج T، امواج Q جدید، یا یک بلوک شاخه چپ جدید میتواند برای تشخیص AMI استفاده شود.[24] علاوه بر این، از بالارفتن قطعه ST میتوان برای تشخیص سکته قلبی نوع STEMI استفاده کرد. این افزایش باید در V2 و V3 حداقل ۲ میلیمتر (۰٫۲ میلی ولت) برای مردان یا بیش از ۱٫۵ میلیمتر (۰٫۱۵ میلی ولت) برای زنان یا بیش از ۱ میلیمتر (۰٫۱ میلی ولت) در دو لید مجاور دیگر قفسه سینه یا اندامی باشد.[19][24] افزایش ارتفاع ST با آنفارکتوس همراه است و ممکن است قبل از آن تغییراتی نشانگر ایسکمی مانند افتادگی ST یا وارونگی امواج T رخ دهد.[16] این ناهنجاریهای نوار قلب میتوانند به شناسایی محل آنفارکتوس، بر اساس لیدهایی که دچار تغییر شدهاند، کمک کنند.[16] قبل از STEMIها ممکن است ارتفاع موج T افزایش یابد.[19] سایر ناهنجاریهای ECG در ارتباط با عوارض سکته قلبی حاد میوکارد نیز ممکن است مشهود باشد، مانند فیبریلاسیون دهلیزی یا بطنی.[64]
تصویربرداری
تصویربرداری غیرتهاجمی نقش مهمی در تشخیص و توصیف سکته قلبی دارد.[24] آزمایشهایی مانند اشعه ایکس قفسه سینه میتواند برای کشف و رد کردن علل دیگر علائم فرد مورد استفاده قرار گیرد.[24] آزمایشهایی مانند اکوکاردیوگرافی حین استرس و تصویربرداری پرفیوژن میوکارد میتواند تشخیص را در صورت مطابقت با سابقه فرد، معاینه فیزیکی (از جمله معاینه قلب) نوار قلب و نشانگرهای زیستی قلب، تأیید کند.[65]
اکوکاردیوگرافی که نوعی سونوگرافی از قلب است، قادر است قلب، اندازه، شکل آن و هر حرکت غیرطبیعی دیوارههای قلب هنگام ضربان را که ممکن است نشان دهنده سکته قلبی باشد، تجسم کند. از جریان خون میتوان تصویربرداری کرد و برای بهبود تصویر میتوان از رنگهای حاجب استفاده کرد.[24] اسکنهای دیگر با استفاده از کنتراست رادیواکتیو شامل سی تی اسکن SPECT با استفاده از تالیوم، sestamibi (اسکن MIBI) یا تتروفوسمین است. یا اسکن PET با استفاده از Fludeoxyglucose یا rubidium-82.[24] این اسکنهای پزشکی هسته ای میتواند خونرسانی عضلات قلب را تجسم کند.[24] همچنین از SPECT میتوان برای تعیین قابلیت زنده ماندن بافت استفاده کرد و اینکه آیا مناطق ایسکمی قابل القا هستند یا خیر.[24][66]
انجمنهای پزشکی و دستورالعملهای حرفه ای توصیه میکنند که پزشک قبل از انجام آزمایشهای تصویربرداری برای تشخیص، ثابت کند که فرد در معرض خطر بالای ابتلا به سکته قلبی است،[65][67] زیرا چنین آزمایشهایی بعید است روند درمان را تغییر دهد و منجر به افزایش هزینهها میشود.[65] بیمارانی که نوار قلب طبیعی دارند و به عنوان مثال قادر به ورزش هستند، صلاحیت تصویربرداری معمول را ندارند.[65]
پیشگیری
در بین توصیههای سبکهای زندگی و توصیههای فعالیتی برای جلوگیری از سکته قلبی و مواردی که ممکن است به عنوان پیشگیری ثانویه پس از سکته قلبی اولیه در نظر گرفته شود، یک همپوشانی بزرگ وجود دارد[51] که دلیل آن، ریسک فاکتورهای مشترک و هدف مشترک برای کاهش آترواسکلروز است که عروق قلب را تحت تأثیر قرار میدهد.[28]
سبک زندگی
فعالیت بدنی میتواند خطر بیماریهای قلبی عروقی را کاهش دهد و به افراد در معرض خطر توصیه میشود که هفته ای ۱۵۰ دقیقه ورزش هوازی با شدت متوسط یا ۷۵ دقیقه ورزش هوازی سنگین انجام دهند.[68] حفظ وزن مناسب، نوشیدن الکل در حد توصیه شده و ترک سیگار خطر بیماریهای قلبی عروقی را کاهش میدهد.[68]
جایگزینی چربیهای اشباع نشده از قبیل روغن زیتون و روغن کلزا به جای چربیهای اشباع، احتمالاً خطر سکته قلبی را کاهش میدهد،[46] اگرچه توافق جهانی وجود ندارد.[47] برخی از مقامات ملی، اصلاحات غذایی را با توصیههایی از جمله افزایش مصرف نشاسته سبوس دار، کاهش مصرف قند (به ویژه قند تصفیه شده)، مصرف پنج قسمت میوه و سبزیجات روزانه، مصرف دو یا چند قسمت ماهی در هفته و مصرف ۴–۵ قسمت آجیل، دانه یا حبوبات بدون نمک در هفته توصیه میکنند.[68] الگوی غذایی که بیشترین پشتیبانی را دارد رژیمهای مدیترانه ای است.[69] ویتامینها و مکملهای معدنی هیچ اثری اثبات شده ندارند،[70] و همچنین استنولهای گیاهی یا استرولها نیز مفید نیستند.[68]
اقدامات بهداشت عمومی همچنین ممکن است در سطح جمعیتی موجب کاهش خطر سکته قلبی شوند، به عنوان مثال با کاهش رژیمهای غذایی ناسالم (نمک بیش از حد، چربی اشباع و چربی ترانس) از جمله برچسب گذاری مواد غذایی و الزامات بازار و همچنین الزامات سرویسهای پذیرایی و رستورانها و تحریک فعالیت بدنی. این ممکن است بخشی از برنامههای منطقه ای پیشگیری از بیماریهای قلبی عروقی یا از طریق ارزیابی تأثیرات بهداشتی برنامهها و سیاستهای منطقه ای و محلی باشد.[71]
اکثر دستورالعملها ترکیب استراتژیهای مختلف پیشگیری را توصیه میکنند. یک مطالعه مروری کوچرن در سال ۲۰۱۵ برخی شواهد را نشان داد که چنین روشی ممکن است روی فشار خون، شاخص توده بدن و دور کمر تأثیر بگذارد. با این حال، شواهد کافی برای اثرگذاری بر مرگ و میر یا حوادث قلبی عروقی واقعی وجود نداشت.[72]
دارو
داروهای استاتین که برای کاهش کلسترول خون استفاده میکنند، میزان بروز و مرگ و میر ناشی از سکته قلبی را کاهش میدهند.[73] آنها اغلب در افرادی که در معرض خطر بالای بیماریهای قلبی عروقی هستند توصیه میشود.[68]
آسپرین بهطور گسترده در افرادی که در معرض خطر بیشتری برای سکته قلبی قرار دارند مورد مطالعه قرار گرفتهاست. بر اساس مطالعات بیشمار در گروههای مختلف (به عنوان مثال افراد مبتلا به دیابت یا فاقد دیابت)، به نظر نمیرسد فایده آن به اندازه کافی بیشتر از خطر خونریزی بیش از حد باشد.[74][75] با این وجود، بسیاری از دستورالعملهای کار بالینی همچنان توصیه به مصرف آسپرین برای پیشگیری اولیه میکنند،[76] و برخی از محققان بر این باورند افرادی که دارای خطر قلبی عروقی بسیار زیاد هستند اما خطر خونریزی کمی دارند، باید همچنان آسپرین دریافت کنند.[77]
پیشگیری ثانویه
توصیهها شامل قطع سیگار، بازگشت تدریجی به ورزش، خوردن رژیم غذایی سالم، چربی اشباع کم و کلسترول کم و نوشیدن الکل در حد توصیه شده، ورزش و تلاش برای رسیدن به وزن سالم است.[51][78] ورزش حتی در افرادی که دارای استنت یا نارسایی قلبی هستند، ایمن و مؤثر است.[79] و توصیه میشود بعد از ۱ الی ۲ هفته به تدریج شروع شود.[51] در مورد داروهای مورد استفاده و علائم هشدار دهنده افسردگی باید مشاوره داده شود.[51] مطالعات قبلی مکمل اسیدهای چرب امگا ۳ را سودمند میدانستند اما این نظریه تأیید نشدهاست.[78]
داروها
به دنبال حمله قلبی، نیتراتها به مدت دو روز مصرف میشوند و مهار کنندههای ACE خطر مرگ را کاهش میدهند.[80] سایر داروها عبارتند از:
آسپرین تا آخر عمر و همچنین یک عامل ضد پلاکت دیگر مانند کلوپیدوگرل یا تیکاگرلر (درمان ضد پلاکت دوتایی یا DAPT) تا دوازده ماه ادامه مییابد.[78] اگر کسی شرایط پزشکی دیگری داشته باشد که به ضد انعقاد خون نیاز دارد (به عنوان مثال، وارفارین)، ممکن است لازم باشد این داروها بر اساس خطر حوادث بعدی قلبی و همچنین خطر خونریزی تنظیم شوند.[78] در کسانی که استنت داشتهاند، بیش از ۱۲ ماه کلوپیدوگرل به علاوه آسپرین خطر مرگ را تحت تأثیر قرار نمیدهد.[81]
درمان بلاک کننده بتا مانند متوپرولول یا کارودیلول توصیه میشود ظرف ۲۴ ساعت شروع شود به شرط آنکه نارسایی حاد قلبی یا بلوک قلبی وجود نداشته باشد.[19][63] دوز آن باید به بیشترین میزان تحمل افزایش یابد.[78] بر خلاف آنچه مدتها تصور میشد به نظر نمیرسد استفاده از مسدود کنندههای بتا بر میزان خطر مرگ تأثیر بگذارد، احتمالاً به این دلیل که سایر درمانهای MI نیز ارتقا یافتهاست.[82] وقتی داروی مسدودکننده بتا در ۲۴–۷۲ ساعت اول STEMI داده میشود، هیچ انسانی از مرگ نجات نمییابد. با این حال، از هر ۲۰۰ نفر، در ۱ نفر از حمله قلبی مکرر و از هر ۲۰۰ نفر در ۱ نفر از ریتم غیرطبیعی قلب پیشگیری میشود. علاوه بر این، در ۱ از هر ۹۱ نفر، دارو باعث کاهش موقتی توانایی قلب در پمپاژ خون میشود.[83]
درمان با مهارکننده ACE باید ظرف ۲۴ ساعت شروع شود و به مدت نامحدود با بالاترین دوز قابل تحمل ادامه یابد. این در صورتی است که هیچ شواهدی از تشدید نارسایی کلیه، پتاسیم بالا، فشار خون پایین یا تنگی عروق کلیوی شناخته شده وجود نداشته باشد.[51] کسانی که تحمل مهار کنندههای ACE را ندارند ممکن است با یک آنتاگونیست گیرنده آنژیوتانسین II تحت درمان قرار بگیرند.[78]
نشان داده شدهاست درمان با استاتین باعث کاهش مرگ و میر و حوادث بعدی قلبی میشود و باید با هدف کاهش کلسترول LDL شروع شود. داروهای دیگری مانند ازتیمیب نیز ممکن است با این هدف اضافه شوند.[51]
اگر شواهدی از اختلال عملکرد بطن چپ بعد از MI وجود داشته باشد، ممکن است از آنتاگونیستهای آلدوسترون (اسپیرونولاکتون یا اپلرونون) استفاده شود که بهتر است پس از شروع درمان با یک مهار کننده ACE باشد.[78][84]
درمان
سکته قلبی نیاز به مراقبت فوری پزشکی دارد. هدف از درمان، حفظ هرچه بیشتر عضله قلب و جلوگیری از عوارض بعدی است.[28] درمان بستگی به این دارد که سکته قلبی STEMI باشد یا NSTEMI.[51] بهطور کلی درمان به منظور باز کردن انسداد رگهای خونی، کاهش بزرگ شدن لخته خون، کاهش ایسکمی و اصلاح عوامل خطر با هدف جلوگیری از سکته قلبی در آینده است.[28] علاوه بر این، درمان اصلی سکته قلبی از نوع STEMI شامل ترومبولیز یا مداخله کرونر از راه پوست (PCI) است، اگرچه PCI نیز بهطور ایدهآل در طی ۱–۳ روز برای NSTEMI انجام میشود. [۶۹] علاوه بر قضاوت بالینی، از سیستمهای امتیازدهی خطر مانند TIMI و GRACE ممکن است برای تصمیمگیری درمانی استفاده شود.[16][51][85]
درد
درد همراه با سکته قلبی ممکن است با نیتروگلیسیرین یا مرفین درمان شود.[28] نیتروگلیسیرین (در زیر زبان یا به صورت داخل وریدی داده میشود) ممکن است خون رسانی به قلب را بهبود بخشد و بار کاری عضله قلب را کاهش دهد.[28] نیتروگلیسیرین بخش مهمی از درمان به دلیل تسکین درد آن است، اگرچه هیچ فایده ای برای مرگ و میر ندارد.[28][86] از مورفین نیز ممکن است استفاده شود و برای دردهای مرتبط با STEMI مؤثر است.[28]
داروهای ضد لخته
آسپرین، که یک داروی ضد پلاکت است، با دوز بارگیری با هدف کاهش اندازه لخته و کاهش لخته شدن بیشتر در شریان آسیب دیده تجویز میشود.[28][51] مشخص شدهاست که آسپرین حداقل ۵۰٪ از مرگ و میر ناشی از سکته قلبی حاد را کاهش میدهد.[51] مهار کنندههای P2Y12 مانند کلوپیدوگرل، پراسوگرل و تیکاگرلور نیز بهطور همزمان، به شکل دوز بارگیری تجویز میشوند، دوز دارو بستگی به این دارد که آیا در قدم بعدی درمان جراحی یا فیبرینولیز (حل کردن لخته با دارو) در نظر گرفته شدهاست.[51] پراسوگرل و تیکاگرلور در رهنمودهای اروپا و آمریکا توصیه میشود، زیرا آنها با سرعت و ثبات بیشتری نسبت به کلوپیدوگرل فعال میشوند.[51] مهار کنندههای P2Y12 در هر دو مورد NSTEMI و STEMI، از جمله در PCI، توصیه میشود، همچنین شواهدی وجود دارد که مرگ و میر را بهبود میبخشد.[51] هپارینها، به ویژه به شکل شکسته نشده، در چندین نقطه از آبشار لخته عمل میکنند، به جلوگیری از بزرگ شدن لخته کمک میکنند، و همچنین در سکته قلبی داده میشوند، به دلیل شواهدی که نشان میدهد با تجویز آنها میزان مرگ و میر بهبود مییابد.[51] در سناریوهای بسیار پر خطر، ممکن است از مهارکنندههای گیرنده پلاکت گلیکوپروتئین αIIbβ3a مانند اپتیفیباتید یا تیروفیبان استفاده شود.[51]
شواهد متغیری در مورد مزایای این داروها در کاهش مرگ و میر در NSTEMI وجود دارد. یک مطالعهٔ مروری در سال ۲۰۱۴ در مورد مهارکنندههای P2Y12 مانند کلوپیدوگرل نشان داد که تجویز آنها قبل از PCI به افرادی که مشکوک به NSTEMI هستند خطر مرگ را کاهش نمیدهد[87] و همچنین هپارینها خطر مرگ را تغییر نمیدهند.[88] آنها خطر ابتلا به سکته قلبی را در آینده کاهش میدهند.[51][88]
آنژیوگرافی
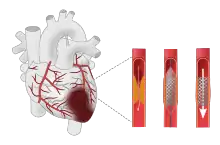
مداخله اولیه کرونر از راه پوست (PCI) در صورتی که بتوان آن را به موقع انجام داد، در حالت ایدهآل طی ۹۰–۱۲۰ دقیقه پس از تماس با یک اورژانس ۱۱۵، درمان انتخابی برای STEMI است.[51][89] برخی توصیه میکنند که این کار در NSTEMI طی ۱ تا ۳ روز انجام شود، خصوصاً درصورتی که بیمار در معرض خطر بالا باشد.[51] با این حال، یک بررسی در سال ۲۰۱۷ تفاوتی بین PCI اولیه و تأخیری در NSTEMI پیدا نکرد.[90] در روش PCI، از پروبهای کوچکی استفاده میشود که از طریق رگهای خونی محیطی مانند شریان فمورال (در کشالهٔ ران) یا شریان رادیال (در دست) به رگهای خونی قلب وارد میشود. سپس از پروبها برای شناسایی و پاکسازی انسداد با استفاده از بالنهای کوچک استفاده میشود، این بالونها از قطعه مسدود شده عبور داده میشود و لخته را پس از باد کردن بالون به عقب میکشد یا اینکه یک استنت پس از باد کردن بالون جاسازی میشود.[28][51] پیوند عروق برای دور زدن محل انسداد در عروق کرونر(CABG) فقط زمانی در نظر گرفته میشود که ناحیه آسیب دیده عضله قلب زیاد باشد و PCI نامناسب باشد، به عنوان مثال در افراد دارای آناتومی پیچیده عروق قلب.[91] پس از PCI، افراد به مدت نامحدود تحت درمان با آسپرین و تحت درمان پلاکت بصورت دو دارویی (بهطور کلی آسپرین و کلوپیدوگرل) قرار میگیرند.[19][51][92]
فیبرینولیز
اگر PCI در طی ۹۰ تا ۱۲۰ دقیقه در STEMI امکانپذیر نباشد، فیبرینولیز، ترجیحاً ظرف ۳۰ دقیقه پس از ورود به بیمارستان، توصیه میشود.[51][93] اگر فردی ۱۲ تا ۲۴ ساعت علائم داشتهاست، شواهد برای اثربخشی ترومبولیز کمتر است و اگر بیش از ۲۴ ساعت علائم داشتهاست، توصیه نمیشود.[94] ترومبولیز شامل تجویز دارویی است که آنزیمهایی را که بهطور معمول لختههای خون را حل میکنند فعال میکند. این داروها شامل فعال کننده پلاسمینوژن بافتی، reteplase، استرپتوکیناز و tenecteplase است.[28]
موارد منع مصرف واضح در استفاده از عوامل فیبرینولیتیک شامل سابقه خونریزی عروق مغزی در هر زمان، سکته مغزی غیرهموراژیک یا سایر حوادث عروقی مغزی در سال گذشته، فشار خون بالا (فشار شریانی سیستولیک با اطمینان تعیین شده> ۱۸۰ میلیمتر جیوه و / یا فشار دیاستولیک> ۱۱۰ میلیمتر جیوه) در هر زمان از تظاهرات حاد، شک به دایسکشن آئورت و خونریزی داخلی فعال (به استثنای قاعدگی). در حالی که سن بالا با افزایش احتمال عوارض خونریزی دهنده همراه است، اما به نظر میرسد اگر هیچ منع مصرف دیگری وجود نداشته باشد و بنظر برسد که مقدار قابل توجهی از میوکارد در معرض خطر است، فواید استفاده از فیبرینولیتیک در افراد مسن استفاده از آن را توجیه میکند.[95]
موارد منع مصرف نسبی برای درمان فیبرینولیتیک، که نیاز به ارزیابی نسبت خطر به سود دارد، شامل استفاده فعلی از داروهای ضد انعقاد خون (INR ≥۲)، یک عمل تهاجمی یا جراحی اخیر (<۲ هفته) یا احیای قلبی ریوی طولانی مدت (> ۱۰ دقیقه)، بیماری خونریزی دهندهٔ شناخته شده، بارداری، بیماری چشم خونریزی دهنده (به عنوان مثال، رتینوپاتی دیابتی خونریزی دهنده)، بیماری زخم معده فعال و سابقه فشار خون شدید که در حال حاضر به میزان کافی کنترل شدهاست. اگر استرپتوکیناز در فاصلهٔ زمانی بین ۵ روز تا ۲ سال قبل دریافت شده باشد، به دلیل خطر واکنش آلرژیک، بیماران نباید استرپتوکیناز دریافت کنند. واکنشهای آلرژیک به استرپتوکیناز در حدود ۲ درصد بیمارانی که آن را دریافت میکنند رخ میدهد. در حالی که درجات جزئی افت فشار خون در ۴–۱۰٪ از بیماران با این دارو رخ میدهد، با این وجود، افت فشار خون قابل توجه، اگرچه به ندرت، همراه با واکنشهای شدید آلرژیک رخ میدهد.[96]
خونریزی شایعترین و بالقوه جدیترین عارضه است. از آنجا که در مواردی که بیماران به روشهای تهاجمی نیاز دارند، دورههای خونریزی که به تزریق خون نیاز دارند شایع تر است، بنابراین در بیمارانی که از عوامل فیبرینولیتیک استفاده میکنند، باید از مداخلات وریدی یا شریانی غیرضروری اجتناب شود. سکته مغزی خونریزی دهنده جدیترین عارضه است و در حدود ۰٫۵–۰٫۹ درصد بیمارانی که تحت درمان با این عوامل هستند رخ میدهد. این میزان با بالا رفتن سن افزایش مییابد، بدین صورت که، بیماران بیشتر از ۷۰ سال در مقایسه با بیماران کمتر از ۶۵ سال تقریباً دو برابر میزان خونریزی داخل جمجمه ای دارند. کارازماییهای بالینی در مقیاس بزرگ نشان میدهد که میزان خونریزی داخل جمجمه با tPA یا rPA کمی بیشتر از استرپتوکیناز است.[97]
بر اساس مطالعات انجام شده در کشورهای با درآمد بالاتر، ترومبولیز قبل از بیمارستان زمان شروع درمان با ترومبولیتیک را کاهش میدهد، اما مشخص نیست که آیا تأثیری بر میزان مرگ و میر دارد یا خیر.[98]
پیش آگهی
پیش آگهی بیمارانی که از یک سندرم حاد کرونر جان سالم به در بردهاند، به میزان باقی مانده ایسکمی میوکارد، میزان آسیب میوکارد و وجود آریتمیهای بطنی مرتبط است. تقریباً در یک چهارم موارد MI، مرگ در عرض چند دقیقه بدون مراقبتهای پزشکی اتفاق میافتد. نیمی از مرگ و میرها طی ۲۴ ساعت از شروع علائم رخ میدهد و حدود ۴۰٪ از کل بیماران مبتلا در ماه اول میمیرند. پیش آگهی کسانی که تا رسیدن به بیمارستان زنده ماندهاند بسیار بهتر است و بیش از ۸۵٪ زنده ماندن در ۲۸ روز اول است. میزان مرگ و میر بیماران با آنژین ناپایدار تقریباً نصف بیماران مبتلا به MI است. مرگ زودرس معمولاً به دلیل آریتمی است و مستقل از وسعت MI است. با این حال، نتایج دیررس بستگی به میزان آسیب میوکارد دارد و از ویژگیهای نامطلوب میتوان به عملکرد ضعیف بطن چپ، بلوک AV و آریتمیهای بطنی مداوم اشاره کرد. پیش آگهی آنفارکتوس قدامی از آنفارکتوس تحتانی بدتر است. بلوک شاخه ای و سطح مارکرهای قلبی بالا هر دو نشان دهنده آسیب گسترده قلبی است. پیری، افسردگی و انزوای اجتماعی نیز با مرگ و میر بالاتر همراه است. از کسانی که از حمله حاد جان سالم به در میبرند، بیش از ۸۰٪ یک سال دیگر، حدود ۷۵٪ ۵ سال، ۵۰٪ ۱۰ سال و ۲۵٪ ۲۰ سال زندگی میکنند.[99]
عوارض
عوارض ممکن است در همه اشکال سندرم حاد کرونر اتفاق بیفتد اما در عصر جدید با احیای فوری یا زودهنگام جریان خون عروق کرونر کمتر دیده می شود. عوارض خاص سندرم حاد کرونر و مدیریت آنها در زیر بحث شده است:
آریتمی
آریتمی در بیماران مبتلا به سندرم کرونر حاد شایع است، اما اغلب گذرا هستند و از نظر همودینامیک یا پیش آگهی اهمیت ندارند. خطر آریتمی را می توان با تسکین درد کافی ، استراحت و اصلاح هیپوکالمی به حداقل رساند. VF در 5-10٪ از بیمارانی که به بیمارستان می رسند رخ می دهد و تصور می شود علت اصلی مرگ و میر در کسانی است که قبل از دریافت مراقبت های پزشکی می میرند. دفیبریلاسیون سریع ریتم سینوسی را برمی گرداند و نجات دهنده حیات است. پیش آگهی بیماران با VF زودرس (در 48 ساعت اول) که با موفقیت و بلافاصله احیا می شوند با بیمارانی که دچار VF نمی شوند یکسان است. وجود آریتمی های بطنی در مرحله نقاهت در سندرم حاد کرونر ممکن است نشانگر عملکرد ضعیف بطن باشد و ممکن است نشانه ای قبل از مرگ ناگهانی باشد. برخی بیماران ممکن است از آزمایش الکتروفیزیولوژیک و درمان ضد آریتمی خاص (از جمله ICDها) سود ببرند. AF یک آریتمی شایع اما گذرا است و معمولاً به درمان فوری نیاز ندارد. با این حال ، اگر باعث پاسخ بطنی سریع همراه با افت فشار خون یا فروپاشی گردش خون شود ، کاردیوورژن سریع ضروری است. در حالت های دیگر ، دیگوکسین یا مسدود کننده β معمولاً درمان انتخابی است. AF ممکن است یکی از ویژگی های نارسایی قریب الوقوع یا آشکار بطن چپ باشد و در صورت عدم شناسایی و درمان مناسب نارسایی قلبی زمینه ای ، درمان AF ممکن است بی اثر باشد. در صورت ادامه AF ، داروی ضد انعقاد خون لازم است. ممکن است برادی کاردی رخ دهد اما به درمان احتیاج ندارد مگر اینکه افت فشار خون یا اختلال همودینامیکی وجود داشته باشد ، در این صورت ممکن است آتروپین (0.6-1.2 میلی گرم IV) تجویز شود. MI تحتانی ممکن است با اضافه شدن بلوک AV عارضه دار شود ، که معمولاً موقتی است و اغلب پس از احیای مجدد جریان خون برطرف می شود. در صورت وخامت حال بالینی به دلیل بلوک AV درجه 2 یا کامل ، باید یک ضربان ساز موقت در نظر گرفته شود. بلوک AV که در اثر انفارکتوس قدامی ایجاد می شود جدی تر است زیرا ممکن است به طور ناگهانی آسیستول بدهد. یک ضربان ساز موقت بطور پیشگیرانه باید در این بیماران قرار داده شود.[100]
آنژین مکرر
بیمارانی که به دنبال سندرم حاد کرونر دچار آنژین مکرر در حالت استراحت یا با حداقل فعالیت می شوند ، در معرض خطر بالایی هستند و باید آنها را برای آنژیوگرافی سریع کرونر با هدف برقراری مجدد جریان عروق کرونر در نظر گرفت. بیماران مبتلا به تغییرات پویا در ECG و درد مداوم باید با آنتاگونیست های گیرنده گلیکوپروتئین IIb / IIIa داخل وریدی درمان شوند. بیمارانی که دارای درد مقاوم یا تغییرات همودینامیکی آشکار هستند باید از نظر نیاز به بالون پمپ داخل آئورت (intra aortic balloon counterpulsation) و بازگشایی مجدد عروق کرونر مورد بررسی قرار گیرند. آنژین پس از انفارکتوس در 50٪ بیماران تحت درمان با ترومبولیز رخ می دهد. اکثر بیماران با وجود ترومبولیز موفق، دارای تنگی باقیمانده در رگ مربوط به انفارکتوس هستند و وجود میوکارد زنده در پایین دست ممکن است باعث آنژین شود. به همین دلیل ، تمام بیمارانی که ترومبولیز موفقیت آمیز دریافت کرده اند ، باید برای آنژیوگرافی عروق کرونر زودرس (در 6 تا 24 ساعت اول) با هدف بازگشایی مجدد عروق کرونر مد نظر قرار گیرند.[101]
منابع
- "What Are the Signs and Symptoms of Coronary Heart Disease?". www.nhlbi.nih.gov. September 29, 2014. Archived from the original on 24 February 2015. Retrieved 23 February 2015.
- "Heart Attack Symptoms in Women". American Heart Association.
- "What Is a Heart Attack?". www.nhlbi.nih.gov. December 17, 2013. Archived from the original on 19 February 2015. Retrieved 24 February 2015.
- "Heart Attack or Sudden Cardiac Arrest: How Are They Different?". www.heart.org. Jul 30, 2014. Archived from the original on 24 February 2015. Retrieved 24 February 2015.
- Mehta PK, Wei J, Wenger NK (February 2015). "Ischemic heart disease in women: a focus on risk factors". Trends in Cardiovascular Medicine. 25 (2): 140–51. doi:10.1016/j.tcm.2014.10.005. PMC 4336825. PMID 25453985.
- Mendis S, Puska P, Norrving B (2011). Global atlas on cardiovascular disease prevention and control (PDF) (1st ed.). Geneva: World Health Organization in collaboration with the World Heart Federation and the World Stroke Organization. pp. 3–18. ISBN 978-92-4-156437-3. Archived from the original (PDF) on 2014-08-17.
- "How Is a Heart Attack Diagnosed?". www.nhlbi.nih.gov. December 17, 2013. Archived from the original on 24 February 2015. Retrieved 24 February 2015.
- Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, et al. (October 2012). "ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation". European Heart Journal. 33 (20): 2569–619. doi:10.1093/eurheartj/ehs215. PMID 22922416.
- O'Connor RE, Brady W, Brooks SC, Diercks D, Egan J, Ghaemmaghami C, et al. (November 2010). "Part 10: acute coronary syndromes: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care". Circulation. 122 (18 Suppl 3): S787–817. doi:10.1161/CIRCULATIONAHA.110.971028. PMID 20956226.
- Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (GBD 2015 Disease Injury Incidence Prevalence Collaborators) (October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- Coventry LL, Finn J, Bremner AP (2011). "Sex differences in symptom presentation in acute myocardial infarction: a systematic review and meta-analysis". Heart & Lung. 40 (6): 477–91. doi:10.1016/j.hrtlng.2011.05.001. PMID 22000678.
- Valensi P, Lorgis L, Cottin Y (March 2011). "Prevalence, incidence, predictive factors and prognosis of silent myocardial infarction: a review of the literature". Archives of Cardiovascular Diseases. 104 (3): 178–88. doi:10.1016/j.acvd.2010.11.013. PMID 21497307.
- "What Causes a Heart Attack?". www.nhlbi.nih.gov. December 17, 2013. Archived from the original on 18 February 2015. Retrieved 24 February 2015.
- Devlin RJ, Henry JA (2008). "Clinical review: Major consequences of illicit drug consumption". Critical Care. 12 (1): 202. doi:10.1186/cc6166. PMC 2374627. PMID 18279535.
- "Electrocardiogram". NHLBI, NIH. 9 December 2016. Archived from the original on 11 April 2017. Retrieved 10 April 2017.
- Colledge NR, Walker BR, Ralston SH, Davidson LS (2010). Davidson's principles and practice of medicine (21st ed.). Edinburgh: Churchill Livingstone/Elsevier. pp. 588–599. ISBN 978-0-7020-3085-7.
- Hamm CW, Bassand JP, Agewall S, Bax J, Boersma E, Bueno H, et al. (December 2011). "ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC)". European Heart Journal. 32 (23): 2999–3054. doi:10.1093/eurheartj/ehr236. PMID 21873419.
- White HD, Chew DP (August 2008). "Acute myocardial infarction". Lancet. 372 (9638): 570–84. doi:10.1016/S0140-6736(08)61237-4. PMC 1931354. PMID 18707987.
- O'Gara PT, Kushner FG, Ascheim DD, Casey DE, Chung MK, de Lemos JA, et al. (January 2013). "2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines". Circulation. 127 (4): e362–425. doi:10.1161/CIR.0b013e3182742cf6. PMID 23247304.
- Moran AE, Forouzanfar MH, Roth GA, Mensah GA, Ezzati M, Flaxman A, et al. (April 2014). "The global burden of ischemic heart disease in 1990 and 2010: the Global Burden of Disease 2010 study". Circulation. 129 (14): 1493–501. doi:10.1161/circulationaha.113.004046. PMC 4181601. PMID 24573351.
- Torio C (August 2013). "National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2011". HCUP. Archived from the original on 14 March 2017. Retrieved 1 May 2017.
- Morrow & Braunwald 2016, pp. 1-3; Dwight 2016, p. ۴۱.
- Morrow & Braunwald 2016, pp. ۱–۳.
- Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, et al. (October 2012). "Third universal definition of myocardial infarction". Circulation. 126 (16): 2020–35. doi:10.1161/CIR.0b013e31826e1058. PMID 22923432.
- Blumenthal & Margolis 2007, pp. ۴–۵.
- Morrow & Bohula 2016, p. ۲۹۵.
- Morrow 2016, pp. ۵۹–۶۱.
- Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J (2015). Harrison's principles of internal medicine. McGraw Hill Education. pp. 1593–1610. ISBN 978-0-07-180215-4. OCLC 923181481.
- Morrow 2016, pp. ۵۹–۶۰.
- Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J (2015). Harrison's Principles of Internal Medicine. McGraw Hill Education. pp. 98–99. ISBN 978-0-07-180215-4. OCLC 923181481.
- Gupta R, Munoz R (August 2016). "Evaluation and Management of Chest Pain in the Elderly". Emergency Medicine Clinics of North America. 34 (3): 523–42. doi:10.1016/j.emc.2016.04.006. PMID 27475013.
- Marcus GM, Cohen J, Varosy PD, Vessey J, Rose E, Massie BM, et al. (January 2007). "The utility of gestures in patients with chest discomfort". The American Journal of Medicine. 120 (1): 83–9. doi:10.1016/j.amjmed.2006.05.045. PMID 17208083.
- Allison 2012, p. 197; Morrow 2016, p. ۶۰.
- Canto JG, Goldberg RJ, Hand MM, Bonow RO, Sopko G, Pepine CJ, Long T (December 2007). "Symptom presentation of women with acute coronary syndromes: myth vs reality". Archives of Internal Medicine. 167 (22): 2405–13. doi:10.1001/archinte.167.22.2405. PMID 18071161.
- Ashton R, Raman D. "Dyspnea". www.clevelandclinicmeded.com. Cleveland Clinic. Archived from the original on 11 July 2017. Retrieved 24 May 2017.
- Lilly LS (2012). Pathophysiology of Heart Disease: A Collaborative Project of Medical Students and Faculty. Lippincott Williams & Wilkins. p. 172. ISBN 978-1-4698-1668-5. Archived from the original on 2017-07-28.
- Van de Werf F, Bax J, Betriu A, Blomstrom-Lundqvist C, Crea F, Falk V, et al. (December 2008). "Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarction of the European Society of Cardiology". European Heart Journal. 29 (23): 2909–45. doi:10.1093/eurheartj/ehn416. PMID 19004841.
- Davis TM, Fortun P, Mulder J, Davis WA, Bruce DG (March 2004). "Silent myocardial infarction and its prognosis in a community-based cohort of Type 2 diabetic patients: the Fremantle Diabetes Study". Diabetologia. 47 (3): 395–399. doi:10.1007/s00125-004-1344-4. PMID 14963648. S2CID 12567614.
- Rubin E, Gorstein F, Rubin R, Schwarting R, Strayer D (2001). Rubin's Pathology — Clinicopathological Foundations of Medicine. Maryland: Lippincott Williams & Wilkins. p. 549. ISBN 978-0-7817-4733-2.
- Gaziano & Gaziano 2016, p. ۱۱–۲۲.
- Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren M, et al. (July 2012). "European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts)". European Heart Journal. 33 (13): 1635–701. doi:10.1093/eurheartj/ehs092. PMID 22555213.
- Smith SC, Allen J, Blair SN, Bonow RO, Brass LM, Fonarow GC, et al. (May 2006). "AHA/ACC guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease: 2006 update endorsed by the National Heart, Lung, and Blood Institute". Journal of the American College of Cardiology. 47 (10): 2130–9. doi:10.1016/j.jacc.2006.04.026. PMID 16697342.
- Kivimäki M, Nyberg ST, Batty GD, Fransson EI, Heikkilä K, Alfredsson L, et al. (October 2012). "Job strain as a risk factor for coronary heart disease: a collaborative meta-analysis of individual participant data". Lancet. 380 (9852): 1491–7. doi:10.1016/S0140-6736(12)60994-5. PMC 3486012. PMID 22981903.
- Lee IM, Shiroma EJ, Lobelo F, Puska P, Blair SN, Katzmarzyk PT (July 2012). "Effect of physical inactivity on major non-communicable diseases worldwide: an analysis of burden of disease and life expectancy". Lancet. 380 (9838): 219–29. doi:10.1016/S0140-6736(12)61031-9. PMC 3645500. PMID 22818936.
- Steptoe A, Kivimäki M (April 2012). "Stress and cardiovascular disease". Nature Reviews. Cardiology. 9 (6): 360–70. doi:10.1038/nrcardio.2012.45. PMID 22473079. S2CID 27925226.
- Hooper L, Martin N, Jimoh OF, Kirk C, Foster E, Abdelhamid AS (August 2020). "Reduction in saturated fat intake for cardiovascular disease". The Cochrane Database of Systematic Reviews. 8: CD011737. doi:10.1002/14651858.CD011737.pub3. PMID 32827219.
- Chowdhury R, Warnakula S, Kunutsor S, Crowe F, Ward HA, Johnson L, et al. (March 2014). "Association of dietary, circulating, and supplement fatty acids with coronary risk: a systematic review and meta-analysis". Annals of Internal Medicine. 160 (6): 398–406. doi:10.7326/M13-1788. PMID 24723079.
- de Souza RJ, Mente A, Maroleanu A, Cozma AI, Ha V, Kishibe T, et al. (August 2015). "Intake of saturated and trans unsaturated fatty acids and risk of all cause mortality, cardiovascular disease, and type 2 diabetes: systematic review and meta-analysis of observational studies". BMJ. 351: h3978. doi:10.1136/bmj.h3978. PMC 4532752. PMID 26268692.
- "Scientific Report of the 2015 Dietary Guidelines Advisory Committee" (PDF). health.gov. Feb 2015. p. 17. Archived from the original (PDF) on 2016-05-03. Retrieved 2015-03-05.
- Krenz M, Korthuis RJ (January 2012). "Moderate ethanol ingestion and cardiovascular protection: from epidemiologic associations to cellular mechanisms". Journal of Molecular and Cellular Cardiology. 52 (1): 93–104. doi:10.1016/j.yjmcc.2011.10.011. PMC 3246046. PMID 22041278.
- Reed GW, Rossi JE, Cannon CP (January 2017). "Acute myocardial infarction". Lancet. 389 (10065): 197–210. doi:10.1016/S0140-6736(16)30677-8. PMID 27502078. S2CID 33523662.
- Colledge NR, Walker BR, Ralston SH, Davidson LS (2010). Davidson's principles and practice of medicine (21st ed.). Edinburgh: Churchill Livingstone/Elsevier. pp. 577–9. ISBN 978-0-7020-3085-7.
- Woollard KJ, Geissmann F (February 2010). "Monocytes in atherosclerosis: subsets and functions". Nature Reviews. Cardiology. 7 (2): 77–86. doi:10.1038/nrcardio.2009.228. PMC 2813241. PMID 20065951.
- Janoudi A, Shamoun FE, Kalavakunta JK, Abela GS (July 2016). "Cholesterol crystal induced arterial inflammation and destabilization of atherosclerotic plaque". European Heart Journal. 37 (25): 1959–67. doi:10.1093/eurheartj/ehv653. PMID 26705388.
- Buja LM (July 2005). "Myocardial ischemia and reperfusion injury". Cardiovascular Pathology. 14 (4): 170–5. doi:10.1016/j.carpath.2005.03.006. PMID 16009313.
- Bolooki HM, Askari A (August 2010). "Acute Myocardial Infarction". www.clevelandclinicmeded.com. Archived from the original on 28 April 2017. Retrieved 24 May 2017.
- Aaronson PI, Ward JP, Connolly MJ (2013). The cardiovascular system at a glance (4th ed.). Chichester, West Sussex: Wiley-Blackwell. pp. 88–89. ISBN 978-0-470-65594-8.
- Kutty RS, Jones N, Moorjani N (November 2013). "Mechanical complications of acute myocardial infarction". Cardiology Clinics (Review). 31 (4): 519–31, vii–viii. doi:10.1016/j.ccl.2013.07.004. PMID 24188218.
- Kloner R, Hale SL (15 September 2016). "Reperfusion Injury: Prevention and Management". In Morrow DA. Myocardial Infarction: A Companion to Braunwald's Heart Disease. Elsevier. pp. 286–288. ISBN 978-0-323-35943-6.
- Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White HD (January 2019). "Fourth universal definition of myocardial infarction (2018)". European Heart Journal. 40 (3): 237–269. doi:10.1093/eurheartj/ehy462. PMID 30165617.
- Pickering JW, Than MP, Cullen L, Aldous S, Ter Avest E, Body R, et al. (May 2017). "Rapid Rule-out of Acute Myocardial Infarction With a Single High-Sensitivity Cardiac Troponin T Measurement Below the Limit of Detection: A Collaborative Meta-analysis". Annals of Internal Medicine. 166 (10): 715–724. doi:10.7326/M16-2562. PMID 28418520.
- Chapman AR, Lee KK, McAllister DA, Cullen L, Greenslade JH, Parsonage W, et al. (November 2017). "Association of High-Sensitivity Cardiac Troponin I Concentration With Cardiac Outcomes in Patients With Suspected Acute Coronary Syndrome". JAMA. 318 (19): 1913–1924. doi:10.1001/jama.2017.17488. PMC 5710293. PMID 29127948.
- Amsterdam EA, Wenger NK, Brindis RG, Casey DE, Ganiats TG, Holmes DR, et al. (December 2014). "2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines". Circulation. 130 (25): e344–426. doi:10.1161/CIR.0000000000000134. PMID 25249585.
- Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J (2015). Harrison's principles of internal medicine. McGraw Hill Education. p. 1457. ISBN 978-0-07-180215-4. OCLC 923181481.
- "American College of Cardiology". www.choosingwisely.org. Choosing Wisely. 28 February 2017. Archived from the original on 28 July 2017. Retrieved 24 May 2017.
- Schinkel AF, Valkema R, Geleijnse ML, Sijbrands EJ, Poldermans D (May 2010). "Single-photon emission computed tomography for assessment of myocardial viability". EuroIntervention. 6 Suppl G (Supplement G): G115–22. PMID 20542817.
- National Institute for Health and Clinical Excellence. Clinical guideline cg94: Unstable angina and NSTEMI. London, 2010.
- National Institute for Health and Clinical Excellence. Clinical guideline 181: Lipid modification: cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease. London, 2014.
- Stradling C, Hamid M, Taheri S, Thomas GN (2014). "A review of dietary influences on cardiovascular health: part 2: dietary patterns". Cardiovascular & Hematological Disorders Drug Targets. 14 (1): 50–63. doi:10.2174/1871529x14666140701095426. PMID 24993125.
- Fortmann SP, Burda BU, Senger CA, Lin JS, Whitlock EP (December 2013). "Vitamin and mineral supplements in the primary prevention of cardiovascular disease and cancer: An updated systematic evidence review for the U.S. Preventive Services Task Force". Annals of Internal Medicine. 159 (12): 824–34. doi:10.7326/0003-4819-159-12-201312170-00729. PMID 24217421.
- McPherson K, et al. (June 2010). "Prevention of cardiovascular disease – NICE public health guidance 25". London: National Institute for Health and Care Excellence. Archived from the original on 2014-03-29.
- Ebrahim S, Taylor F, Ward K, Beswick A, Burke M, Davey Smith G (January 2011). "Multiple risk factor interventions for primary prevention of coronary heart disease". The Cochrane Database of Systematic Reviews (1): CD001561. doi:10.1002/14651858.cd001561.pub3. PMC 4160097. PMID 21249647.
- Taylor F, Huffman MD, Macedo AF, Moore TH, Burke M, Davey Smith G, et al. (January 2013). "Statins for the primary prevention of cardiovascular disease". The Cochrane Database of Systematic Reviews. 1 (1): CD004816. doi:10.1002/14651858.CD004816.pub5. PMC 6481400. PMID 23440795.
- Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, et al. (May 2009). "Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials". Lancet. 373 (9678): 1849–60. doi:10.1016/S0140-6736(09)60503-1. PMC 2715005. PMID 19482214.
- Sutcliffe P, Connock M, Gurung T, Freeman K, Johnson S, Kandala NB, et al. (September 2013). "Aspirin for prophylactic use in the primary prevention of cardiovascular disease and cancer: a systematic review and overview of reviews". Health Technology Assessment. 17 (43): 1–253. doi:10.3310/hta17430. PMC 4781046. PMID 24074752.
- Matthys F, De Backer T, De Backer G, Stichele RV (March 2014). "Review of guidelines on primary prevention of cardiovascular disease with aspirin: how much evidence is needed to turn a tanker?". European Journal of Preventive Cardiology. 21 (3): 354–65. doi:10.1177/2047487312472077. PMID 23610452. S2CID 28350632.
- Hodis HN, Mack WJ (July 2014). "Hormone replacement therapy and the association with coronary heart disease and overall mortality: clinical application of the timing hypothesis". The Journal of Steroid Biochemistry and Molecular Biology. 142: 68–75. doi:10.1016/j.jsbmb.2013.06.011. PMID 23851166. S2CID 30838065.
- Anderson L, Taylor RS (December 2014). "Cardiac rehabilitation for people with heart disease: an overview of Cochrane systematic reviews". The Cochrane Database of Systematic Reviews. 12 (12): CD011273. doi:10.1002/14651858.CD011273.pub2. hdl:10871/19152. PMC 7087435 Check
|pmc=value (help). PMID 25503364. - Perez MI, Musini VM, Wright JM (October 2009). "Effect of early treatment with anti-hypertensive drugs on short and long-term mortality in patients with an acute cardiovascular event". The Cochrane Database of Systematic Reviews (4): CD006743. doi:10.1002/14651858.CD006743.pub2. PMID 19821384.
- Elmariah S, Mauri L, Doros G, Galper BZ, O'Neill KE, Steg PG, et al. (February 2015). "Extended duration dual antiplatelet therapy and mortality: a systematic review and meta-analysis". Lancet. 385 (9970): 792–8. doi:10.1016/S0140-6736(14)62052-3. PMC 4386690. PMID 25467565.
- Bangalore S, Makani H, Radford M, Thakur K, Toklu B, Katz SD, et al. (October 2014). "Clinical outcomes with β-blockers for myocardial infarction: a meta-analysis of randomized trials". The American Journal of Medicine. 127 (10): 939–53. doi:10.1016/j.amjmed.2014.05.032. PMID 24927909.
- Newman D (19 August 2010). "Beta Blockers for Acute Heart Attack (Myocardial Infarction)". TheNNT.com. Archived from the original on 22 December 2015. Retrieved 11 December 2015.
- Le HH, El-Khatib C, Mombled M, Guitarian F, Al-Gobari M, Fall M, et al. (2016). "Impact of Aldosterone Antagonists on Sudden Cardiac Death Prevention in Heart Failure and Post-Myocardial Infarction Patients: A Systematic Review and Meta-Analysis of Randomized Controlled Trials". PLOS ONE. 11 (2): e0145958. Bibcode:2016PLoSO..1145958L. doi:10.1371/journal.pone.0145958. PMC 4758660. PMID 26891235.
- Hess EP, Agarwal D, Chandra S, Murad MH, Erwin PJ, Hollander JE, et al. (July 2010). "Diagnostic accuracy of the TIMI risk score in patients with chest pain in the emergency department: a meta-analysis". CMAJ. 182 (10): 1039–44. doi:10.1503/cmaj.092119. PMC 2900327. PMID 20530163.
- Reeder G (27 December 2016). "Nitrates in the management of acute coronary syndrome". www.uptodate.com. Archived from the original on 28 July 2017. Retrieved 24 May 2017.
- Bellemain-Appaix A, Kerneis M, O'Connor SA, Silvain J, Cucherat M, Beygui F, et al. (October 2014). "Reappraisal of thienopyridine pretreatment in patients with non-ST elevation acute coronary syndrome: a systematic review and meta-analysis". BMJ. 349: g6269. doi:10.1136/bmj.g6269. PMC 4208629. PMID 25954988.
- Andrade-Castellanos CA, Colunga-Lozano LE, Delgado-Figueroa N, Magee K (June 2014). "Heparin versus placebo for non-ST elevation acute coronary syndromes". The Cochrane Database of Systematic Reviews. 6 (6): CD003462. doi:10.1002/14651858.CD003462.pub3. PMC 6769062 Check
|pmc=value (help). PMID 24972265. - Bagai A, Dangas GD, Stone GW, Granger CB (June 2014). "Reperfusion strategies in acute coronary syndromes". Circulation Research. 114 (12): 1918–28. doi:10.1161/CIRCRESAHA.114.302744. PMID 24902975.
- Jobs A, Mehta SR, Montalescot G, Vicaut E, Van't Hof AW, Badings EA, et al. (August 2017). "Optimal timing of an invasive strategy in patients with non-ST-elevation acute coronary syndrome: a meta-analysis of randomised trials". Lancet. 390 (10096): 737–746. doi:10.1016/S0140-6736(17)31490-3. PMID 28778541. S2CID 4489347.
- Wijns W, Kolh P, Danchin N, Di Mario C, Falk V, Folliguet T, et al. (October 2010). "Guidelines on myocardial revascularization". European Heart Journal. 31 (20): 2501–55. doi:10.1093/eurheartj/ehq277. PMID 20802248.
- Dalal F, Dalal HM, Voukalis C, Gandhi MM (July 2017). "Management of patients after primary percutaneous coronary intervention for myocardial infarction". BMJ. 358: j3237. doi:10.1136/bmj.j3237. PMID 28729460. S2CID 46847680.
- Lassen JF, Bøtker HE, Terkelsen CJ (January 2013). "Timely and optimal treatment of patients with STEMI". Nature Reviews. Cardiology. 1. 10 (1): 41–8. doi:10.1038/nrcardio.2012.156. PMID 23165072. S2CID 21955018.
- Neumar RW, Shuster M, Callaway CW, Gent LM, Atkins DL, Bhanji F, et al. (November 2015). "Part 1: Executive Summary: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care". Circulation. 132 (18 Suppl 2): S315–67. doi:10.1161/cir.0000000000000252. PMID 26472989.
- Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J (2020). Harrison's principles of internal medicine (20th ed.). McGraw Hill Education isbn=978-1-259-64403-0. p. 1879.
- Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J (2020). Harrison's principles of internal medicine (20th ed.). McGraw Hill Education isbn=978-1-259-64403-0. p. 1879.
- Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J (2020). Harrison's principles of internal medicine (20th ed.). McGraw Hill Education isbn=978-1-259-64403-0. p. 1879.
- McCaul M, Lourens A, Kredo T (September 2014). "Pre-hospital versus in-hospital thrombolysis for ST-elevation myocardial infarction". The Cochrane Database of Systematic Reviews. 9 (9): CD010191. doi:10.1002/14651858.CD010191.pub2. PMC 6823254 Check
|pmc=value (help). PMID 25208209. - Ralston SH, Penman ID, J Strachan MW, Hobson RP (2020). Davidson's Principles and Practice of Medicine (23th ed.). Elsevier isbn=978-0-7020-7028-0. p. 501.
- Ralston SH, Penman ID, J Strachan MW, Hobson RP (2020). Davidson's Principles and Practice of Medicine (23th ed.). Elsevier isbn=978-0-7020-7028-0. p. 495.
- Ralston SH, Penman ID, J Strachan MW, Hobson RP (2020). Davidson's Principles and Practice of Medicine (23th ed.). Elsevier isbn=978-0-7020-7028-0. p. 495.
مشارکتکنندگان ویکیپدیا. «Myocardial infarction». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۰ آوریل ۲۰۲۱.
پیوند به بیرون
| در ویکیانبار پروندههایی دربارهٔ سکته قلبی موجود است. |
- سکته قلبی چیست؟ (انگلیسی)
- Myocardial Infarction
https://www.heart.org/en/health-topics/heart-attack/about-heart-attacks
