اندومتر
اندومتر (به انگلیسی: Endometrium)، بهمراه غشاء مخاطی اش، لایه اپیتلیال داخلی رحم را تشکیل می دهد. اندومتر، دارای یک لایه قاعدهای، و یک لایه عملکردیست؛ لایه عملکردی ضخیم شده و سپس طی دوره قاعدگی در انسانها و برخی از سایر پستانداران شامل این موارد، فرو میریزد: میمونهای انساننما، میمونهای دنیای قدیم، برخی از خفاشها، حشرهخوار فیلی[1] و موش خارپشت قاهره.[2] در بسیاری از سایر پستانداران، اندومتر در دوره فحلی دوباره جذب می شود. طی بارداری، اندازه و تعداد غدد و عروق خونی در اندومتر بیشتر میشوند. فضاهای عروقی با هم جوش خورده و از درون متصل گشته، تشکیل جفت داده تا اکسیژن و مواد غذایی را به رویان و جنین برسانند.[3][4] در مورد حضور میکروبیوتای اندومتری، فرضیهسازی و ادعایی عنوان شد[5] که در مخالفت با آن بحث شده است.[6][7]
| اندومتر | |
|---|---|
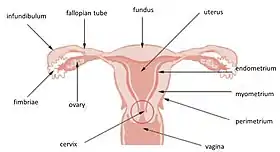 لولهٔ رحم و رحم (اندومتر در سمت راست مرکز نشانهگذاری شدهاست) | |
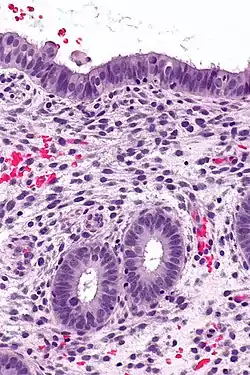 اندومتر در مرحلهٔ تکثیر | |
| جزئیات | |
| بخشی از | رحم |
| شناسهها | |
| لاتین | tunica mucosa uteri |
| MeSH | D004717 |
| TA98 | A09.1.03.027 |
| TA2 | 3521 |
| FMA | 17742 |
طبقهبندی و ساختار
بافت اندومتر شامل دو لایه است:
- بافت پایهای (بازال) که همیشه باقی میماند و به عنوان بافت مادر در مراحل مختلف رشد اندومتر عمل میکند.
- بافت کاربردی که در مراحل قاعدگی دچار تغییر میشود و بعد از ریزش در خونریزی قاعدگی مجدداً از بافت پایه ایجاد میشود.
بافت اندومتر پس از تخمکگذاری موفقیتآمیز و لقاح و تشکیل سلول تخم، جفت را تشکیل میدهد.
در غیاب پروژسترون، سرخرگهایی که خون را به لایهٔ عملکردی تحمیل میکنند ضعیف میشوند، به طوری که سلولهای موجود در آن لایه میمیرند و منجر به قاعدگی میشوند. ممکن است فاز چرخهٔ قاعدگی را با اشاره به چرخهٔ تخمدان یا چرخهٔ رحم با رعایت تفاوتهای میکروسکوپی در هر فاز، به عنوان مثال در دوره و چرخهٔ عملکرد تخمدان شناسایی کنید:
| فاز | روزها | ضخامت | اپیتلیوم یا بافت پوششی |
| مرحلهٔ قاعدگی | ۱–۵ | نازک | وجود ندارد یا تشکیل نشدهاست |
| فاز فولیکولی | ۵–۱۴ | حد وسط | به شکل ستون وجود دارد |
| فاز لوتئال | ۱۵–۲۷ | ضخیم | ستون و عروق انسدادی رحم قابل مشاهده است |
| فاز ایسکمیک | ۲۷–۲۸ | ستون و عروق انسدادی رحم قابل مشاهده است |
اصلاح ژن و پروتئین
حدود ۲۰٬۰۰۰ ژن کدکنندهٔ پروتئین در سلولهای انسانی وجود دارد و حدود ۷۰٪ از این ژنها در آستر طبیعی ظاهر میشوند. فقط بیش از ۱۰۰ تای این ژنها بهطور خاص در اندومتر دارای خاصیت آندومتری هستند. پروتئینهای خاص مربوط در سلولهای غدد لنفاوی و استرومای مخاط مخاطی اندومتر وجود دارد. وجود بسیاری از این پروتئینها بسته به چرخهٔ قاعدگی متفاوت است، برای مثال گیرندهٔ پروژسترون و هورمون آزادکنندهٔ تیروتروپین هر دو در مرحلهٔ پرولیفراتیو و PAEP بیانشده در مرحلهٔ ترشحی مشاهده میشوند. پروتئینهای دیگر مانند پروتئین HOX11 که برای باروری زنان مورد نیاز است، در سلولهای استرومای اندومتری در طول دورهٔ قاعدگی ترشح میشود، برخی از پروتئینهای خاص مانند گیرندهٔ استروژن نیز در انواع دیگری از انواع بافتهای بدن زنان مانند دهانهٔ رحم، لولههای رحم، تخمدانها و پستان وجود دارد. سرطان گردن رحم در سلولهای پوشش دادهشده روی دهانهٔ رحم شروع میشود یعنی از قسمت پایین رحم که سرویکس رحم نیز نامیده میشود.[8]
عملکرد
اندومتریوم درونیترین لایهٔ رحم است و برای جلوگیری از چسبندگی بین دیوارههای مخالف میومتریم عمل میکند و در نتیجه از رحم محافظت میکند. طی چرخهٔ قاعدگی، اندومتریوم به شکل لایهٔ بافتی غدد لنفاوی ضخیم و رگهای خونی رشد میکند. این نشاندهنده یک محیط مطلوب برای پیوند بلستوسیست پس از ورود آن به رحم است. اندومتریوم مرکزی، اکوژنیک و قابل تشخیص با استفاده از اسکنرهای اولتراسوند است و دارای ضخامت متوسط ۶٫۷ میلیمتر است.
در طول بارداری، غدد و رگهای خونی در اندومتر در اندازه و تعداد بیشتری افزایش مییابند. فضاهای عروقی با هم مخلوط و به یکدیگر متصل میشوند که اکسیژن و غذا را به جنین میرساند.
دوره
پوشش آندومتر بعد از خونریزی هر سیکل قاعدگی دوباره تحت بازسازی قرار میگیرد. انسانها، میمونها و برخی دیگر گونههای موجودات هم دورهٔ قاعدگی را دارند، درحالیکه اکثر پستانداران دیگر چرخهٔ غضروف دارند که در هر دو مورد، آندومتر ابتدا تحت تأثیر استروژن قرار میگیرد. با این حال، هنگامی که تخمکگذاری رخ میدهد، تخمدان و به ویژه کپسول لوتوم، مقدار زیادی از پروژسترون تولید میکند. در نهایت، پوشش تراکم یک محیط پذیرا را برای یک یا چند بلاستوسیست فراهم میکند. پس از لقاح، تخم ایجادشده میتواند به دیوارهٔ رحم بپیوندد و همراه با گنادوتروپین جفتی انسان؛ HCG، نقش خود را در آزادسازی پروژسترون و استروژن ادامه خواهد داد.
بنابراین، بافت آندومتر یا دوباره جذب میشود یا با ریختن باعث پریود میشود که در مورد دوم، فرایند ریختن شامل تخریب پوشش، ریزش عروق خونی همراه و از دست دادن بافت و خون است. کل پروسه طی چند روز اتفاق میافتد. قاعدگی ممکن است با یک سری از انقباضات رحم همراه باشد. با این حال، در مورد لانهگزینی، پوشش اندومتری نه جذب و نه ریخته میشود. در عوض فقط باقی میماند و سپس تبدیل به بخشی از جفت خواهد شد که باعث محافظت لازم را در دوران بارداری فراهم میکند.
در انسان، چرخهٔ ساخت و ریختن این بافت پوششی بهطور متوسط ۲۸ روز طول میکشد. اندومتریوم در پستانداران به شکلهای مختلف رشد میکند. عوامل مختلف از جمله فصلها، آبوهوا و استرس میتواند بر این رشد تأثیر بگذارد. اندومتریوم خود هورمونهای خاصی را در مراحل مختلف چرخه تولید میکند و این دیگر بخشهای سیستم تولیدمثل را تحت تأثیر قرار میدهد.
ضخامت اندومتر
ضخامت معمول اندومتر بین ۷ تا ۹ میلیمتر است و ضخامت اندومتری کمتر از ۷ میلیمتر، میزان بارداری و باروری را کاهش میدهد. با این حال، چنین ضخامت کمی به ندرت رخ میدهد. همچنین ضخامت بالاتر از ۹ نیز اغلب زیاد عنوان شدهاست.
ضخامت اندومتر که توسط سونوگرافی واژینال اندازهگیری شده معمولاً به شرح زیر است اما توجه داشته باشید که این اندازهگیریها فقط یک راهنما هستند، زیرا ضخامت اندومتر ممکن است از فرد به فردی دیگر متغیر باشد:
پیش از یائسگی
ضخامت اندومتر قبل از یائسگی، در مراحل مختلف چرخهٔ قاعدگی، تغییرات قابل توجهی وجود دارد:
- در طول قاعدگی: ۲ تا ۴ میلیمتر
- فاز اولیهٔ پرولیفراتیو (روزهای ۶–۱۴): ۵ تا ۷ میلیمتر
- فاز اواخر پرولیفراتیو: تا ۱۱ میلیمتر
- فاز ترشحاتی: ۷ تا ۱۶ میلیمتر
- پس از جراحی و کورتاژ یا سقط خودبهخودی: بزرگتر از ۵ میلیمتر[9]
پس از یائسگی یا منوپاز
ضخامت اندومتر پس از یائسگی معمولاً کمتر از ۵ میلیمتر است اما اندازههای مختلف ضخامت برای ارزیابی بیشتر پیشنهاد شدهاست:
- در صورت خونریزی واژینال بدون مصرف تاموکسیفن: حداکثر حد نرمال استاندارد کمتر از ۵ میلیمتر است.
- در درمان جایگزینی هورمونی یعنی با مصرف تاموکسیفن: حد بالای آن ۵ میلیمتر است.
- بدون هیچ سابقهٔ خونریزی واژینال: محدودهٔ قابل قبول ضخامت اندومتر در این گروه تا ۱۱ میلیمتر است.
- در صورت مصرف تاموکسیفن: بیشتر از ۸ میلیمتر است.
بیماریهای مرتبط با اندومتر
بافت کوریونی یا جفتی ممکن است منجر به تغییراتی در اندومتر مشخص شود. آریاس-استلا به عنوان یک واکنش شناخته شدهاست که در ظاهر شبیه به سرطان است. واکنش آریاس-استلا سبب میشود که شناسایی سلولهای غدهای آتیپیک در پاپ اسمیر زمان حاملگی دشوار باشد. این تغییر به عنوان سرطان آندومتر تشخیص داده شد. بیماریهای مرتبط با اندومتر به شرح زیر است:
- آدنومایوز یا میومتریم که رشد اندومتر در لایهٔ عضلانی رحم است.
- اندومتریوز که رشد بافت اندومتری در خارج از رحم است.
- هیپرپلازی اندومتر؛ هیپرپلازی اندومتر زمانی اتفاق میافتد که غدد اندومتر شما باعث رشد سریع بافت میشود.[10]
- سرطان آندومتر که شایعترین سرطان دستگاه تناسلی زنان است. تقریباً تمام سرطانهای رحم از سلولهای اندومتر شروع میشوند. داشتن اندومتری ضعیف و غیرطبیعی میتواند یک نشانهٔ اولیه برای سرطان رحم باشد.[11]
- سندرم اشرمن (به انگلیسی: Asherman) که به عنوان چسبندگی داخل رحمی نیز شناخته میشود که زمانی رخ میدهد که لایهٔ پایه و اصلی آندومتر با ابزار و اشیایی آسیب دیده یا عفونت کردهاست. این مشکل منجر به تشکیل اسکلروز اندومتر و تشکیل چسبندگی کم یا زیاد در رحم میشود.
اندومتری نازک ممکن است کمتر از ۸ میلیمتر تعریف شود و معمولاً پس از یائسگی اتفاق میافتد. درمانهایی که میتوانند ضخامت اندومتر را بهبود بخشد شامل ویتامین E یا الآرژنین و سیلدنافیل سیترات است.
منابع
- Emera, D; Romero, R; Wagner, G (January 2012). "The evolution of menstruation: a new model for genetic assimilation: explaining molecular origins of maternal responses to fetal invasiveness". BioEssays. 34 (1): 26–35. doi:10.1002/bies.201100099. PMC 3528014. PMID 22057551.
- Bellofiore, N.; Ellery, S.; Mamrot, J.; Walker, D.; Temple-Smith, P.; Dickinson, H. (2016-06-03). "First evidence of a menstruating rodent: the spiny mouse (Acomys cahirinus)". bioRxiv: 056895. doi:10.1101/056895.
- Blue Histology - Female Reproductive System. School of Anatomy and Human Biology — The University of Western Australia Accessed 20061228 20:35
- Guyton AC, Hall JE, eds. (2006). "Chapter 81 Female Physiology Before Pregnancy and Female Hormones". Textbook of Medical Physiology (11th ed.). Elsevier Saunders. pp. 1018ff. ISBN 9780721602400.
- Franasiak, Jason M.; Scott, Richard T. (2015). "Reproductive tract microbiome in assisted reproductive technologies". Fertility and Sterility. 104 (6): 1364–1371. doi:10.1016/j.fertnstert.2015.10.012. ISSN 0015-0282. PMID 26597628.
- Baker, JM; Chase, DM; Herbst-Kralovetz, MM (2018). "Uterine Microbiota: Residents, Tourists, or Invaders?". Frontiers in Immunology. 9: 208. doi:10.3389/fimmu.2018.00208. PMC 5840171. PMID 29552006.
- Perez-Muñoz, ME; Arrieta, MC; Ramer-Tait, AE; Walter, J (28 April 2017). "A critical assessment of the "sterile womb" and "in utero colonization" hypotheses: implications for research on the pioneer infant microbiome". Microbiome. 5 (1): 48. doi:10.1186/s40168-017-0268-4. PMC 5410102. PMID 28454555.
- "What Is Cervical Cancer?". www.cancer.org. Retrieved 2018-11-27.
- Weerakkody, Yuranga. "Endometrial thickness | Radiology Reference Article | Radiopaedia.org". radiopaedia.org. Retrieved 2018-11-27.
- "Endometrial Stripe: Average Size, Symptoms of Thickening, and More". Retrieved 2018-11-27.
- "What Is Endometrial Cancer?". www.cancer.org. Retrieved 2018-11-27.
- مشارکتکنندگان ویکیپدیا. «Endometrium». در دانشنامهٔ ویکیپدیای انگلیسی.
پیوندهای بیرونی
- SUNY Figs 43:05-15 - "The uterus, uterine tubes and ovary with associated structures."
- Histology image: 18902loa - Histology Learning System at Boston University - "Female Reproductive System uterus, endometrium"
- Swiss embryology (from UL, UB, and UF) gnidation/role02
- Histology image: 20_01 at the University of Oklahoma Health Sciences Center
- Histology at utah.edu. Slide is proliferative phase - click forward to see secretory phase
