هندسه مولکولی هرمی لوزیپهلو
در شیمی هرم لوزیپهلو نوعی هندسه مولکولی با یک اتم در راس و سه اتم در قاعده در گوشهها به شکل لوزیپهلو است که شکلی همانند یک چهاروجهی را یادآوری میکند (با هندسه مولکولی چهاروجهی اشتباه نشود). اگر هر سه اتم گوشهها یکسان باشند، مولکول از نوع تقارن مولکولی C3v خواهد بود برای مثال میتوان به زنون تریاکسید، یون کلرات و یون سولفیت اشاره کرد. گاهی در شیمی آلی مولکولهایی با هندسهٔ هرمی لوزیپهلو به شکل sp3 هیبرید شده توصیف میشوند. روش AXE برای نظریهٔ VSEPR بیان میدارد که آنها در ردهٔ AX3E1 جای دارند.
فسفین یک نمونه مولکول با هدسهٔ هرمی لوزیپهلو یا تریگونال است.
هندسهٔ هرمی لوزیپهلو در آمونیاک
نیتروژن موجود در آمونیاک، ۵ الکترون لایهٔ ظرفیت دارد و با سه اتم هیدروژن در پیوند است تا یک قاعده هشتتایی تشکیل دهد. این مطلب منجر به یک چهاروجهی منتظم با زاویهای تقریباً برابر با ۱۰۹٫۵ درجه یا cos−1(−13) میشود. البته سه اتم هیدروژن توسط الکترونهای غیر پیوندی چنان رانده میشوند که هندسه تبدیل به یک هرم لوزیپهلو با زاویههای ۱۰۷ درجه شود. در مقابل در تریفلورید بور هندسه، تخت است و شکل لوزیپهلوی صفحهای بدست میآید. چون بور الکترونهای غیر پیوندی ندارد. در آمونیاک، هرم لوزیپهلو خیلی سریع دچار وارونگی نیتروژن میشود.[1]
منابع
- Cleeton, C. E.; Williams, N. H. (1934). "Electromagnetic Waves of 1.1 cm Wave-Length and the Absorption Spectrum of Ammonia". Phys. Rev. 45: 234. doi:10.1103/PhysRev.45.234.
جستارهای وابسته
 آرایش جفت الکترون در آمونیاک چهاروجهی است، دو الکترون ناپیوندی به رنگ زرد و هیدروژن به رنگ سفید نشان داده شدهاست.
آرایش جفت الکترون در آمونیاک چهاروجهی است، دو الکترون ناپیوندی به رنگ زرد و هیدروژن به رنگ سفید نشان داده شدهاست.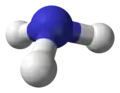 هندسهٔ مولکولی را میتوان از روی جفت الکترونها بدست آورد که در آمونیاک هندسهٔ هرمی لوزیپهلو را ایجاد کردهاست.
هندسهٔ مولکولی را میتوان از روی جفت الکترونها بدست آورد که در آمونیاک هندسهٔ هرمی لوزیپهلو را ایجاد کردهاست.
