نیتراسیون
نیتراسیون به یک ردهای از فرایندهای شیمیایی گفته میشود که در آن ترکیبات نیترو با یک ترکیب شیمیایی آلی وارد واکنش میشود. گاهی به نادرست این عبارت به فرایند میان الکل و اسید نیتریک که در اثر آن استر نیترات تولید میشود هم نیتراسیون میگویند مانند تولید نیتروگلیسیرین. تفاوت ساختاری میان ترکیبهای نیترات و ترکیبهای نیتروژن دار این است که اتم نیتروژن در ترکیبات نیتروژنی بهطور مستقیم به یک اتم غیر اکسیژن پیوند خورده است که این اتم معمولاً کربن یا یک نیتروژن دیگر است در حالی که در استرهای نیترات که به آنها نیتراتهای ارگانیک هم میگویند، نیتروژن به یک اتم اکسیژن پیوند خورده که البته خود آن هم به یک کربن وصل است.
نیتراسیون در صنعت به فراوانی کاربرد دارد از آن جمله میتوان به تولید ترکیبات نیتروآروماتیک مانند نیتروبنزن اشاره کرد. در تولید مواد منفجره مانند تبدیل گوانیدین به نیتروگوانیدین یا تبدیل تولوئن به تری نیترو تولوئن هم به فراوانی بهره برده میشود. سالانه میلیونها تن نیتروآروماتیک تولید میشود.[1]
نیتراسیون آروماتیک
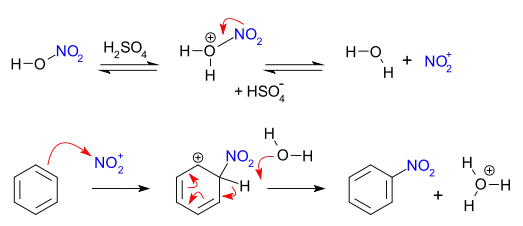
معمولاً در فرایندهای نیتراسیون چیزی به نام «اسید مخلوط» (mixed acid) وجود دارد که آمیختهای است از اسید نیتریک غلیظ و اسید سولفوریک.[2] این مخلوط، یون نیترونیم (الگو:الگو چر) تولید میکند که خود بخش فعال در نیتراسیون آروماتیک است. این مادهٔ اولیهٔ فعال که در حالتی که نیترونیومتترافلوروبورات داشته باشیم، میتوان آن را ایزوله کرد، بدون نیاز به اسید مخلوط هم میتواند بر نیتراسیون اثر بگذارد. در اسید مخلوط، اسید سولفوریک مصرف نمیشود بلکه به عنوان فروکافت و جاذب آب کاربرد دارد. برای نیتراسیون بنزن واکنش در دمای ۵۰ درجه سانتیگراد صورت میگیرد و فرایند آن نمونهای از جانشینی الکتروندوستی آروماتیکی است که در آن حملهای توسط حلقهٔ پر از الکترون بنزن صورت میگیرد:
ساز و کارهای دیگری هم پیشنهاد شدهاند که از آن جمله میتوان به انتقال یک تک الکترون اشاره کرد (SET).[3][4]
واکنش هدف
گزینش بهینه از مهمترین بخشهای نیتراسیون است چون ترکیبات آن میتواند به محصولات متفاوتی منجر شود که برخی از آنها مواد آلایندهاند و برخی دیگر تنها هدر دادن سرمایه. از این رو ترجیح آن است که از پیش واکنشها را به بهترین شکل طراحی کنیم: برای نمونه میتوان به کنترل شرایط واکنش یا اینکه فلورنون سه نیتراته (trinitrated) باشد[5] یا چهارنیتراته (tetranitrated) اشاره کرد.[6]
سه نیتراته برای هنگامی است که بنزن به صورت متقارن سه نیتراته است.
منابع
- Gerald Booth "Nitro Compounds, Aromatic" Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_411
- John McMurry Organic Chemistry 2nd Ed.
- Esteves, P. M. ; Carneiro, J. W. M. ; Cardoso, S. P. ; Barbosa, A. G. H. ; Laali, K. K. ; Rasul, G. ; Prakash, G. K. S. ; e Olah, G. A. (2003). "Unified Mechanism Concept of Electrophilic Aromatic Nitration Revisited: Convergence of Computational Results and Experimental Data". J. Am. Chem. Soc. 125 (16): 4836–49. doi:10.1021/ja021307w. PMID 12696903.
- Queiroz, J. F. ; Carneiro, J. W. M. ; Sabino A. A. ; Sparapan, R. ; Eberlin, M. N. ; Esteves, P. M. (2006). "Electrophilic Aromatic Nitration: Understanding Its Mechanism and Substituent Effects". J. Org. Chem. 71 (16): 6192–203. doi:10.1021/jo0609475. PMID 16872205.
- E. O. Woolfolk and Milton Orchin, "2,4,7-Trinitrofluorenone", Org. Synth.; Coll. Vol., 3: 837 Missing or empty
|title=(help) - Melvin S. Newman and H. Boden, "2,4,5,7-Tetranitrofluorenone", Org. Synth.; Coll. Vol., 5: 1029 Missing or empty
|title=(help)