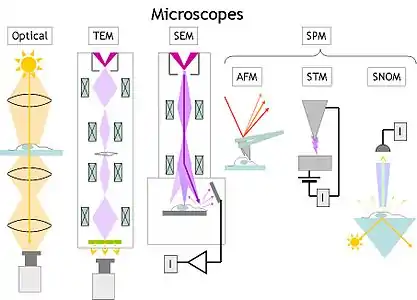
میکروسکوپ الکترونی
میکروسکوپ الکترونی به دستهای از میکروسکوپها گفته میشود که از یک باریکه الکترونی برای تصویرسازی استفاده میکنند. از آنجا که طول موج یک الکترون میتواند تا ۱۰۰٫۰۰۰ برابر کوتاهتر از فوتونهای نور مرئی باشد، میکروسکوپهای الکترونی از قدرت تفکیک بالاتری نسبت به میکروسکوپهای نوری برخوردار بوده و میتوانند ساختار اجسام کوچکتر را نمایان سازند.
یک میکروسکوپ (STEM (Scanning Transmission Electron Microscope میتواند در زمینه تاریک و در مقیاس 50pm حدود ۱۰٬۰۰۰٬۰۰۰ بزرگنمایی داشته باشد. در حالی که میکروسکوپهای نوری محدود به مقیاس 200nm و بزرگنمایی کمتر از ۲۰۰۰ هستند.[1]
میکروسکوپهای الکترونی از میدانهای مغناطیسی شکل استفاده میکنند تا سیستمهای لنز نوری الکترونی را تشکیل دهند که مشابه لنزهای شیشه ای میکروسکوپ نوری است. میکروسکوپهای الکترونی برای بررسی زیر ساختاری طیف گستردهای از نمونههای بیولوژیکی و معدنی از جمله میکروارگانیسمها، سلولها، مولکولهای بزرگ، نمونههای بیوپسی، فلزات و کریستالها استفاده میشوند. از نظر صنعتی، میکروسکوپهای الکترونی اغلب برای کنترل کیفیت و تجزیه و تحلیل شکست استفاده میشوند. میکروسکوپهای الکترونیکی مدرن با استفاده از دوربینهای دیجیتالی و قابهای مخصوص قاب برای گرفتن تصاویر میکروگراف الکترونی تولید میکنند.
تاریخچه
| بخشی از یک مجموعه دربارهٔ مقالههای |
| نانوفناوری |
|---|
|
| تاثیر و برنامههای کاربردی |
|
| نانومواد |
| خودآرایی مولکولی |
|
| نانو الکترونیک |
|
| نانومترولوژی |
|
| نانوفناوری مولکولی |
|
|
در سال ۱۹۲۶ هانس بوش لنز الکترومغناطیسی را توسعه داد.[2]
میکروسکوپ الکترونی توسط فیزیکدان مجارستانی لیو زیلارد اختراع و ثبت شد. با این حال در سال ۱۹۳۱ ارنست روسکا فیزیکدان آلمانی و مکس نول مهندس برق نمونه میکروسکوپ الکترونی را با قدرت ۴۰۰ برابر بزرگنمایی ساختند. دو سال بعد در ۱۹۳۳ روسکا یک میکروسکوپ الکترونی با قدرت بزرگنمایی بیش از بزرگنمایی قابل حصول از یک میکروسکوپ نوری ساخت. رینولد رودنبرگ مدیر علمی زیمنس-شوکرت ورک اختراع میکروسکوپ الکترونی را در ۱۹۳۱ ثبت کرد. بیماری خانواده مهندس برق را مجبور به ساخت یک میکروسکوپ الکتروستاتیکی کرد، زیرا او میخواست ویروس فلج اطفال را ببیند.[3]
در سال ۱۹۳۲ ارنست لابک از زیمنس اند هالسکه آن را ساخت و عکسهایی از نمونه اولیه میکروسکوپ الکترونی با استفاده از مفاهیم شرح داده شده دربرنامههای ثبت شده رودنبرگ به دست آورد. سال ۱۹۳۳، روسکا اولین میکروسکوپ الکترونی را ساخت که از میکروسکوپ نوری (نوری) قابل دستیابی بیشتر بود. ۵ سال بعد در ۱۹۳۷ شرکت تأمین مالی کار ارنست روسکا و بودو بوریس، و استخدام هلموت روسکا (برادر ارنست) به منظور توسعه برنامههای کاربردی برای میکروسکوپ، خصوصاً با نمونههای زیستی تأسیس شد. همچنین در ۱۹۳۷ مانفرد فون آردن پیشگام ساخت میکروسکوپ اسکن الکترونی شد. نخستین تلاش عملی برای ساخت میکروسکوپ الکترونی در سال ۱۹۳۸، در دانشگاه تورنتو، بدست الی فرانکلین بورتون و دانشجویان سیسیل، جیمز هیلر، و آلبرت پرباس انجام گرفت و نخستین سری تجاری میکروسکوپ انتقال الکترونی در سال ۱۹۳۹ محصول زیمنس بود. اگرچه همزمان با میکروسکوپهای الکترونی دارای دو میلیون قدرت بزرگنمایی، به عنوان ابزار علمی هم چنان آنها بر اساس نمونهٔ روسکا باقیماندند.[4]
انواع میکروسکوپ الکترونی
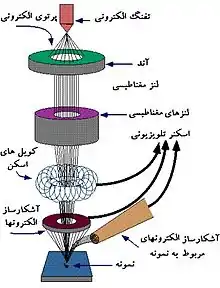
میکروسکوپ الکترونی عبوری
میکروسکوپ الکترونی عبوری (TEM)، از یک پرتو الکترونی با ولتاژ بالا برای روشن کردن نمونه و ایجاد تصویر استفاده میکند. پرتوی الکترون توسط یک تفنگ الکترونی تولید میشود، که معمولاً با یک کاتد رشته رشته تنگستن به عنوان منبع الکترون نصب میشود. پرتو الکترون با توجه به کاتد، توسط یک آند معمولاً در ۱+ کیلو ولت (۴۰ تا ۴۰۰ کیلو ولت) شتاب مییابد، توسط لنزهای الکترواستاتیک و الکترومغناطیسی متمرکز میشود و از طریق نمونه منتقل میشود که تا حدودی شفاف به الکترونها است و در بخشی آنها را پراکنده میکند. از پرتو هنگامی که از نمونه بیرون میآید، پرتوی الکترونی اطلاعاتی در مورد ساختار نمونه که توسط سیستم لنز عینی میکروسکوپ بزرگ شدهاست، حمل میکند. تغییر مکان در این اطلاعات ("تصویر") ممکن است با نمایش تصویر الکترونی بزرگنمایی روی صفحه نمایش فلورسنت پوشش داده شده با یک فسفر یا ماده اسکنلاتور مانند سولفید روی مشاهده شود. از طرف دیگر، با قرار دادن یک فیلم یا صفحه عکاسی بهطور مستقیم در پرتو الکترون، میتوان عکس را ضبط کرد، یا یک فسفر با وضوح بالا ممکن است با استفاده از یک سیستم نوری لنز یا یک راهنمای نوری فیبر نوری به سنسور دیجیتال وصل شود. دوربین. تصویر شناسایی شده توسط دوربین دیجیتال ممکن است در مانیتور یا رایانه نمایش داده شود.
وضوح TEMها در درجه اول با انحراف کروی محدود است، اما نسل جدیدی از اصلاح کنندههای سختافزاری میتوانند باعث کاهش عدم تغییر کروی شوند تا رزولوشن را در میکروسکوپ الکترونی عبوری با وضوح بالا (HRTEM) به کمتر از ۰٫۵ آنگستروم (۵۰ پیکومتر) افزایش دهند، امکان بزرگنمایی بالای ۵۰ میلیون بار دارد.[5]توانایی (HRTEM) در تعیین موقعیت اتمها در مواد برای تحقیق و توسعه فناوری نانو بسیار مفید است.[6]
میکروسکوپهای الکترونی انتقال اغلب در حالت پراش الکترونی استفاده میشوند. از مزایای پراش الکترون نسبت به کریستالوگرافی اشعه X این است که نمونه نیازی به یک کریستال یا حتی پودر پلی کریستالی نیست، و همچنین اینکه بازسازی تبدیل فوریه ساختار بزرگ شده جسم از نظر جسمی اتفاق میافتد و در نتیجه از لزوم حل مسئله فاز جلوگیری میکند. کریستالوگرافیهای اشعه ایکس پس از به دست آوردن الگوهای پراش پرتو X با آنها روبرو شدهاند.
یکی از مضرات میکروسکوپ الکترونی عبوری، نیاز به بخشهای بسیار نازک نمونهها، بهطور معمول حدود ۱۰۰ نانومتر است. ایجاد این بخشهای نازک برای نمونههای بیولوژیکی و مواد از لحاظ فنی بسیار چالشبرانگیز است. بخشهای نازک نیمه هادی را میتوان با استفاده از پرتو یون متمرکز ساخت. نمونههای بافت بیولوژیکی از نظر شیمیایی تثبیت شده، کمآبی و در یک رزین پلیمری تعبیه شدهاند تا آنها را به اندازه کافی تثبیت کنند تا بخشبندی اولتراتین انجام شود. برای دستیابی به تضاد تصویر لازم، بخشهایی از نمونههای بیولوژیکی، پلیمرهای آلی و مواد مشابه ممکن است نیاز به رنگ آمیزی با برچسب اتم سنگین داشته باشد.
میکروسکوپ الکترونی تسلسلی
یکی از کاربردهای SEM میکروسکوپ الکترونی تسلسلی (Serial-section Electron Microscope) است که برای مثال در تجزیه و تحلیل اتصال در نمونههای حجمی بافت مغز با تصویربرداری از بسیاری از بخشهای نازک استفاده میشود.[7]
میکروسکوپ الکترونی روبشی
SEM با جستجوی نمونه با پرتو الکترونی متمرکز که در ناحیه مستطیل شکل نمونه (اسکن شطرنج) اسکن میشود، تصاویر را تولید میکند. هنگامی که پرتوی الکترون با نمونه در تعامل باشد، توسط مکانیسمهای گوناگون انرژی خود را از دست میدهد. انرژی از دست رفته به اشکال جایگزین مانند گرما ، انتشار الکترونهای ثانویه با انرژی کم و الکترونهای کم مصرف با انرژی پرتراکم ، انتشار نور (کاتدولومینسانسسانس) یا انتشار اشعه ایکس تبدیل میشود، که همه اینها سیگنالهای حامل اطلاعات در مورد خواص نمونه را ارائه میدهند. سطح، مانند توپوگرافی و ترکیب آن. تصویری که توسط یک SEM نمایش داده میشود، شدت متفاوت هر یک از این سیگنالها را در تصویر در موقعیتی متناسب با موقعیت پرتو در نمونه هنگام تولید سیگنال نقشهبرداری میکند. در تصویر SEM مورچه ای که در زیر و سمت راست نشان داده شدهاست، این تصویر از سیگنالهای تولید شده توسط یک ردیاب الکترونی ثانویه، حالت تصویربرداری عادی یا معمولی در اکثر SEMها ساخته شدهاست.
بهطور کلی وضوح تصویر یک SEM نسبت به TEM پایینتر است. با این حال، به دلیل اینکه SEM سطح یک نمونه را به جای داخلی آن تصویر میکند، الکترونها مجبور نیستند از طریق نمونه عبور کنند. این امر نیاز به آمادهسازی گسترده نمونه را برای نازک شدن نمونه برای شفافیت الکترونی کاهش میدهد. SEM قادر به نمونه برداریهای فله ای است که میتوانند در صحنه آن جا بگیرند و هنوز هم مانور داده شوند، از جمله ارتفاع کمتری نسبت به فاصله کاری که استفاده میشود، اغلب ۴ میلیمتر برای تصاویر با وضوح بالا. SEM همچنین از عمق میدان بسیار خوبی برخوردار است و به همین ترتیب میتواند تصاویری تولید کند که نمایانگر خوبی از شکل سطح سه بعدی نمونه هستند. یکی دیگر از مزایای SEMها میکروسکوپهای الکترونی روبشی محیطی (ESEM) است که میتواند تصاویر با کیفیت و وضوح خوب را با نمونههای هیدراته یا در خلاء کم، به جای زیاد، خلاء یا تحت گازهای محفظه تولید کند. این کار تصویربرداری از نمونههای بیولوژیکی ناقص است که در خلاء بالای میکروسکوپهای الکترونی معمولی ناپایدار است.
میکروسکوپ الکترونی انعکاسی
در میکروسکوپ الکترونی بازتابی (REM) مانند TEM، یک پرتو الکترونی روی یک سطح اتفاق میافتد اما به جای استفاده از انتقال (TEM) یا الکترونهای ثانویه (SEM)، پرتوی منعکس شده از الکترونهای پراکنده الاستیک تشخیص داده میشود. این روش بهطور معمول با پراش الکترون پر انرژی (RHEED) و بازتاب انرژی با بازتاب بالا (RHELS) همراه است. [نیاز به استناد] یکی دیگر از تغییرات میکروسکوپ الکترونی الکترونی کم انرژی اسپین-قطبی (SPLEEM) است که برای جستجوی آن استفاده میشود ساختار ساختار حوزه مغناطیسی.[8]
میکروسکوپ الکترونی انتقالی روبشی
REMER STEM یک کاوشگر حادثه ای متمرکز در سراسر نمونه ای است که (مانند TEM) برای تسهیل در تشخیص الکترونهای پراکنده شده در این نمونه نازک شدهاست. وضوح بالای TEM در STEM امکانپذیر است. عمل تمرکز (و انحرافات) قبل از برخورد الکترونها در نمونه در STEM رخ میدهد، اما پس از آن در TEM. استفاده از STEMهای شستشوی پرتو SEM مانند تصویربرداری در زمینه تاریک حلقوی و سایر تکنیکهای تحلیلی را سادهتر میکند، بلکه به این معنی است که دادههای تصویر به صورت سریال و نه به صورت موازی بدست میآیند. غالباً TEM میتواند به گزینه اسکن مجهز شود و سپس میتواند به عنوان TEM و STEM عمل کند.
میکروسکوپ طونلی روبشی
در STM، یک نوک رسانا که در ولتاژ نگه داشته میشود، در نزدیکی یک سطح قرار میگیرد و بر اساس احتمال تونل زنی یک الکترون از نوک به نمونه میتوان یک پروفایل را بدست آورد زیرا این یک تابع مسافت است.
رنگ
در رایجترین پیکربندیهای خود، میکروسکوپهای الکترونیکی تصاویری با مقدار روشنایی منفرد در هر پیکسل تولید میکنند، با نتایجی که معمولاً در مقیاس خاکستری ارائه میشود.[9] با این حال، اغلب این تصاویر با استفاده از نرمافزار تشخیص ویژگی یا به سادگی با ویرایش دستی با استفاده از ویرایشگر گرافیک، رنگ آمیزی میشوند. این ممکن است برای روشن سازی ساختار یا برای اثر زیباییشناسی انجام شود و بهطور کلی اطلاعات جدیدی در مورد نمونه اضافه نمیشود.[10]
در بعضی از پیکربندیها، اطلاعات در مورد چندین خاصیت نمونه در هر پیکسل جمع میشود، معمولاً با استفاده از چندین آشکارساز.[11] در SEM، صفات توپوگرافی و کنتراست مواد را میتوان با یک جفت آشکارساز الکترونی پشتیبان بدست آورد و چنین ویژگیهایی با اختصاص یک رنگ اصلی متفاوت به هر ویژگی میتوانند در یک تصویر واحد قرار بگیرند. به همین ترتیب، ترکیبی از سیگنالهای الکترونی پشتی و پراکنده را میتوان به رنگهای مختلف اختصاص داد و روی یک میکروگراف رنگی یکسان قرار دادیم که همزمان خواص نمونه را نشان میدهد.[12]
برخی از انواع آشکارسازهای مورد استفاده در SEM دارای قابلیتهای تحلیلی هستند و میتوانند چندین آیتم از داده را در هر پیکسل ارائه دهند. نمونههایی از آشکارسازهای طیفسنجی اشعه ایکس پراکندگی انرژی (EDS) است که در آنالیز عنصری و سیستمهای میکروسکوپ کاتدولومینسانس (CL) استفاده میشود که شدت و طیف لومینسانس ناشی از الکترون را در نمونههای زمینشناسی (مثلاً) تجزیه و تحلیل میکنند. در سیستمهای SEM با استفاده از این آشکارسازها، رنگ آمیزی سیگنالها و سوار کردن آنها در یک تصویر واحد رنگ معمول است، به طوری که تفاوتها در توزیع اجزای مختلف نمونه به روشنی و مقایسه قابل مشاهده است. به صورت اختیاری میتوان تصویر الکترونیکی ثانویه استاندارد را با یک یا چند کانال ترکیبی ادغام کرد، به طوری که میتوان ساختار و ترکیب نمونه را مقایسه کرد. چنین تصاویری میتوانند ضمن حفظ تمامیت سیگنال اصلی ساخته شوند که به هیچ وجه اصلاح نشدهاست.
آمادهسازی نمونه
موادی که در زیر میکروسکوپ الکترونی مشاهده میشوند ممکن است نیاز به پردازش داشته باشد تا یک نمونه مناسب داشته باشد. روش مورد نیاز بسته به نمونه و آنالیز مورد نیاز متفاوت است:
- تثبیت شیمیایی - برای نمونههای بیولوژیکی، تثبیت ساختار ماکرومولکولی متحرک نمونه از طریق اتصال متقاطع شیمیایی پروتئینها با آلدهیدها مانند فرمالدئید و گلوتارآلدئید، و لیپیدها با اسید تتروکسید انجام میشود.
- لکه منفی - سوسپانسیونهای حاوی نانوذرات یا مواد بیولوژیکی ریز (مانند ویروسها و باکتریها) بهطور خلاصه با یک محلول رقیق شده از یک محلول الکترون مات مانند مولیبات آمونیوم، اورانیل استات (یا فرمت) یا اسید فسفوت مخلوط میشوند. این مخلوط به یک شبکه EM با روکش مناسب اعمال میشود، مخلوط میشود و سپس اجازه میدهد خشک شود. مشاهده این آمادهسازی در TEM باید بدون تأخیر برای بهترین نتیجه انجام شود. این روش در میکروبیولوژی برای شناسایی مورفولوژیکی سریع اما خام بسیار مهم است، اما همچنین میتواند به عنوان پایه ای برای بازسازی سه بعدی با وضوح بالا با استفاده از روش توموگرافی EM هنگامی که از فیلمهای کربنی برای پشتیبانی استفاده میشود، استفاده شود. از رنگ آمیزی منفی برای مشاهده نانوذرات نیز استفاده میشود.
- Cryofixation - انجماد یک نمونه با سرعت زیاد، در اتان مایع که آب یخ زجاجیه (غیر کریستالی) تشکیل میدهد. این نمونه را در تصویر لحظه ای از حالت حل آن حفظ میکند. فیلد کاملی به نام میکروسکوپ کری الکترون از این تکنیک منشعب شدهاست. با توسعه میکروسکوپ کریو الکترون بخشهای زجاجیه (CEMOVIS)، اکنون میتوان نمونههایی را از تقریباً هر نمونه بیولوژیکی نزدیک به حالت بومی خود مشاهده کرد.
- کمآبی - یا جایگزینی آب با حلالهای آلی مانند اتانول یا استون، و به دنبال آن خشک شدن نقطه بحرانی یا نفوذ با رزینهای جاسازی شده. همچنین خشک کردن یخ.
- جاسازی، نمونههای بیولوژیکی - پس از کمآبی، بافت برای مشاهده در میکروسکوپ الکترونی انتقال جاسازی شدهاست بنابراین میتوان آن را برای مشاهده آماده کرد. برای این کار، بافت از طریق «حلال انتقال» مانند پروپیلن اکسید (اپوکسی پروپان) یا استون عبور داده میشود و سپس با یک رزین اپوکسی مانند آردالیت، اپون یا دورکپان نفوذ میکند. رزین آکریلیک قابل پخش پس از پلیمریزاسیون رزین (سخت شده) نمونه برش نازک (بخشهای اولتراستین) و رنگ آمیزی میشود - سپس برای مشاهده آماده است.
- جاسازی، مواد - پس از جاسازی در رزین، نمونه معمولاً با استفاده از سایندههای بسیار ریز، به صورت آینه مانند صیقل داده میشود. برای به حداقل رساندن خراشها و سایر مصنوعات جلا دهنده که باعث کاهش کیفیت تصویر میشوند، باید فرایند پرداخت با دقت انجام شود.
- سایههای فلزی - فلز (به عنوان مثال پلاتین) از یک الکترود سربار تبخیر میشود و با زاویه ای روی سطح یک نمونه بیولوژیکی اعمال میشود. توپوگرافی سطح منجر به تغییر در ضخامت فلز میشود که در تصویر میکروسکوپ الکترونی تغییراتی در میزان روشنایی و کنتراست مشاهده میشود.[13]
- تکثیر - سطحی سایه دار با فلز (به عنوان مثال پلاتین، یا مخلوطی از کربن و پلاتین) در یک زاویه با کربن خالص تبخیر شده از الکترودهای کربن در زاویههای راست به سطح پوشیده شدهاست. این امر با حذف مواد نمونه (به عنوان مثال در حمام اسیدی، با استفاده از آنزیمها یا جداسازی مکانیکی[14]) به منظور تولید یک ماکت سطحی انجام میشود که زیرساخت سطح را ثبت میکند و با استفاده از میکروسکوپ الکترونی عبوری قابل بررسی است.
- بخشبندی - برشهای نازکی از نمونه، نیمه منتقل به الکترونها تولید میکند. اینها را میتوان با استفاده از یک لیوان یا چاقوی الماس بر روی یک اولترامایکروتوم برش داد تا بخشهایی فوقالعاده نازک به ضخامت ۶۰–۹۰ نانومتر تولید کند. از چاقوهای شیشه یکبار مصرف نیز استفاده میشود زیرا میتوان آنها را در آزمایشگاه ساخت و بسیار ارزانتر هستند.
- رنگ آمیزی - از فلزات سنگین مانند سرب، اورانیوم یا تنگستن برای پراکندگی الکترونهای تصویربرداری استفاده میکند و در نتیجه بین ساختارهای مختلف تضاد ایجاد میکند، زیرا بسیاری از مواد (بویژه بیولوژیکی) برای الکترونها (اشیاء فاز ضعیف) تقریباً "شفاف" هستند. در زیستشناسی، نمونهها میتوانند قبل از جاسازی و همچنین بعداً بعد از برش، "en bloc" رنگ آمیزی شوند. بهطور معمول بخشهای نازک برای چند دقیقه با محلول آبی یا الکلی اورانیل استات و به دنبال آن سیترات سرب آبی آغشته میشوند.
- شکستگی یخ یا یخ زدگی - یک روش آمادهسازی به خصوص برای بررسی غشاهای لیپیدی و پروتئینهای گنجانیده شده آنها در نمای "در چهره" مفید است. بافت تازه یا سیستم تعلیق سلولی به سرعت منجمد میشود (Cryofixation)، سپس با شکستن یا با استفاده از میکروتوم در حالی که در دمای نیتروژن مایع نگهداری میشود، شکسته میشود. سطح شکستگی سرد (گاهی اوقات با افزایش دما تا حدود ۱۰۰ درجه سانتیگراد برای چند دقیقه اجازه میدهد تا مقداری یخ بزرگ شود) با تبخیر پلاتین یا طلا با زاویه متوسط ۴۵ درجه در یک تبخیرکننده خلأ بالا سایه داده میشود. پوشش دوم کربن، عمود بر سطح عمودی تبخیر شده برای بهبود پایداری پوشش ماکت انجام میشود. نمونه به دمای اتاق و فشار برگردانده میشود، سپس ماکت فلزی بسیار شکننده "پیش سایه" سطح شکستگی با هضم دقیق شیمیایی با اسیدها، محلول هیپوکلریت یا مواد شوینده SDS از مواد بیولوژیکی زیرزمین آزاد میشود. ماکت هنوز شناور کاملاً از مواد شیمیایی باقیمانده شسته میشود، با دقت روی شبکههای ریز ماهیگیری میشود، خشک شده و سپس در TEM مشاهده میشود.
- برچسب زدن immunogold ماکت شکستگی یخ (FRIL) - روش یخبندان شکستگی اصلاح شدهاست تا امکان شناسایی اجزای صورت شکستگی با برچسب زدن ایمونوگلد فراهم شود. به جای از بین بردن تمام بافتهای زیرین ماکت ذوب شده به عنوان آخرین مرحله قبل از مشاهده در میکروسکوپ، ضخامت بافت در طی یا بعد از فرایند شکستگی به حداقل میرسد. لایه نازک بافت به ماکت فلز محدود میشود، بنابراین میتوان با استفاده از آنتیبادیها به ساختارهای مورد نظر، ایمونوگلد شد. لایه نازک نمونه اصلی روی ماکت با طلای ضمیمه، امکان شناسایی سازهها در صفحه شکستگی را فراهم میکند. روشهای مرتبط نیز وجود دارد که سطح سلولهای اچ شده[15] و سایر تغییرات برچسب زدن ماکت را نشان میدهد.[16]
- فرز پرتوی یون - نمونههایی از نازک شدن آنها تا زمانی که با شلیک یونها (بهطور معمول آرگون) در سطح از یک زاویه و مواد پاشیده شده از سطح، در برابر الکترونها شفاف نباشند. یک زیر مجموعه از این تراشکاری پرتوهای یون متمرکز است، که در آن از یونهای گالیم برای تولید یک غشای الکترونی شفاف در یک منطقه خاص از نمونه استفاده میشود، به عنوان مثال از طریق دستگاهی در یک ریزپردازنده. تراشکاری پرتوهای یون نیز ممکن است قبل از آنالیز SEM از مواد که تهیه آن با استفاده از پولیش مکانیکی دشوار است، برای پرداخت سطح مقطع استفاده شود.
- پوشش رسانا - یک پوشش اولتراتین از مواد رسانا الکتریکی، که توسط تبخیر خلاء زیاد یا با روکش خلاء کم نمونه، تهویه میشود. این کار برای جلوگیری از تجمع میدانهای الکتریکی ساکن در نمونه به دلیل تابش الکترون مورد نیاز در هنگام تصویربرداری انجام میشود. مواد پوشش شامل طلا، طلا / پالادیوم، پلاتین، تنگستن، گرافیت و غیره است.
- خاکستری - برای جلوگیری از تجمع بار الکتریکی بر روی یک نمونه با روکش رسانا، معمولاً بهصورت الکتریکی به نگهدارنده نمونه فلزی متصل میشود. غالباً برای این منظور از چسب رسانا برقی استفاده میشود.
لنز
میکروسکوپهای الکترونی و یونی به جای نور از پرتویی از ذرات باردار استفاده میکنند و از لنزهای الکترومغناطیسی یا الکترواستاتیک برای تمرکز ذرات استفاده میکنند.
لنزهای الکترواستاتیک از صفحات فلزی متصل به ولتاژ بالا با دیافراگم که پرتوی الکترون از آن عبور میکند تشکیل شدهاست. لنزهای تک دیافراگم از یک صفحه فلزی منفرد با ولتاژ بالا تشکیل شدهاند و غالباً در منابع الکترونی وجود دارد. لنزهای یک دیافراگم میتوانند یک میدان شتاب را خاتمه دهند یا توسط یک میدان شتابدهنده دنبال شوند. در حالت اول، لنز مثبت است، به این معنی که پرتو به یک متقاطع تبدیل میشود. یک لنز دو دیافراگم از دو صفحه فلزی با پتانسیلهای مختلف با دیافراگم تراز وسط قرار دارد. الکترونهایی که وارد این لنز میشوند یک میدان قوی احساس میکنند که آنها را به محور نوری نزدیک تر میکند. با عبور از صفحه دوم، الکترونها نیروی متضادی را احساس میکنند که آنها را به سمت دیافراگم سوق میدهد. به عنوان یک اثر کل، این یک لنز مثبت است و پرتو در یک صفحه زیر صفحه دوم متمرکز شدهاست.
یک لنز Einzel سه دیافراگم از سه صفحه با دیافراگمهای هم تراز تشکیل شدهاست که میتواند قطر یکسانی داشته باشد، یا یک صفحه متفاوت. لنزهای Einzel به دلیل داشتن پتانسیل پرتوی برابر در ورودی و خروجی لنزها معمولاً در نوری الکترونی استفاده میشوند. سه الکترود سه لنز تولید میکنند: اول و سوم مثبت هستند، جایی که خطوط میدان الکتریکی به سمت صفحات نشان میدهند و دوم منفی است. کل لنزها مثبت هستند و پرتو روی یک هواپیما در زیر لنز سوم متمرکز شدهاست. از آنجا که پرتوی الکترون شارژ میشود (منفی)، میتوان از نیروی الکترومغناطیسی به عنوان لنز استفاده کرد. سیم پیچ سیم پرتو را احاطه کرده و چنین میدانی را تولید میکند که نیرویی از افت فشار در الکترونها ایجاد میکند.
لنزهای مغناطیسی از نیروی لورنتس متناسب با بار و سرعت الکترون برای دفع الکترونها استفاده میکنند. لنزهای مغناطیسی از یک بدنه فلزی (به نام مدار فرومغناطیسی) تشکیل شدهاست که با دو قطب قطبی به پایان میرسد. میدان مغناطیسی توسط یک سیم پیچ که در قسمت بالای مدار فرومغناطیسی قرار دارد، داده میشود، همانطور که در شکل ۳ نشان داده شدهاست. قدرت لنز را میتوان با تغییر در میدان مغناطیسی ب تغییر داد. این با تغییر هندسه قطعه قطب انجام میشود. یعنی فاصله بین قطبهای قطبی و جریان موجود در سیم پیچها (برانگیختگی).
معایب
میکروسکوپهای الکترونی برای ساخت و نگهداری گران هستند، اما سرمایه و هزینههای جاری سیستمهای میکروسکوپ کانفوکال در حال حاضر با میکروسکوپهای الکترونیکی اصلی همپوشانی دارند. میکروسکوپهای طراحی شده برای دستیابی به وضوح بالا باید در ساختمانهای با ثبات (گاهی اوقات زیرزمینی) با سرویسهای ویژه مانند سیستمهای لغو میدان مغناطیسی قرار بگیرند.
نمونهها تا حد زیادی باید در خلأ مشاهده شوند، زیرا مولکولهایی که هوا تشکیل میدهند، الکترونها را پراکنده میکنند. یک استثناء میکروسکوپ الکترونی الکترونی فاز با استفاده از یک سلول مایع بسته یا یک محفظه محیطی است، به عنوان مثال، در میکروسکوپ الکترونی روبشی محیطی، که اجازه میدهد نمونههای هیدراته با فشار کم مشاهده شوند (تا 20 Torr یا 2.7 kPa) محیط مرطوب. تکنیکهای مختلفی برای میکروسکوپ الکترونی درجا از نمونههای گازی نیز توسعه یافتهاست.[17]
میکروسکوپهای الکترونی روبشی که در حالت خلاء بالا معمولی کار میکنند، معمولاً از نمونههای رسانای تصویر استفاده میکنند؛ بنابراین مواد غیر رسانا به پوشش رسانا نیاز دارند (آلیاژ طلا / پالادیوم، کربن، اسمی و غیره). حالت کم ولتاژ میکروسکوپهای مدرن، مشاهده نمونههای غیر رسانا بدون پوشش را ممکن میسازد. مواد غیر رسانا نیز میتوانند توسط میکروسکوپ الکترونی روبشی فشار متغیر (یا محیطی) تصویر شوند.
نمونههای کوچک و پایدار مانند نانولولههای کربن، فروستولهای دیاتوم و کریستالهای معدنی کوچک (به عنوان مثال الیاف آزبستو) قبل از بررسی در میکروسکوپ الکترونی نیازی به درمان خاصی ندارند. نمونههایی از مواد هیدراته، از جمله تقریباً تمام نمونههای بیولوژیکی، برای تثبیت آنها، کاهش ضخامت آنها (مقطع اولتراستین) و افزایش کنتراست نوری الکترون (رنگ آمیزی) باید به روشهای مختلفی تهیه شوند. این فرایندها ممکن است به مصنوعات منتهی شوند، اما معمولاً با مقایسه نتایج به دست آمده با استفاده از روشهای تهیه نمونه کاملاً متفاوت، میتوان شناسایی کرد. از دهه ۱۹۸۰، تجزیه و تحلیل نمونههای انجماد شده و انجماد شده نیز بهطور فزاینده ای توسط دانشمندان مورد استفاده قرار گرفت و بیشتر اعتبار این روش را تأیید کرد.[18][19][20]
کاربردها
نیمه هادی و ذخیرهسازی دادهها
زیستشناسی و علوم زندگی
- میکروسکوپ کریو الکترون (Cryo-electron microscopy)[24]
- میکروسکوپ کریو بیولوژی[25]
- میکروسکوپ الکترونی تشخیصی[26]
- تحقیقات دارویی (به عنوان مثال آنتیبیوتیک)[27]
- توموگرافی الکترونی[28]
- آنالیز ذرات[29]
- تشخیص ذرات[30]
- بومی سازی پروتئین[31]
- زیستشناسی ساختاری[25]
- تصویربرداری از بافت[32]
- سمشناسی[33]
- ویروسشناسی (به عنوان مثال نظارت بر بار ویروسی)[34]
تحقیقات مواد
- آزمایش و توصیف دستگاه[35]
- آزمایشها مواد پویا[36]
- رسوب ناشی از پرتو الکترونی[37]
- خصوصیات درجا[38]
- صلاحیت مواد[39]
- تحقیقات پزشکی[27]
- نانومترشناسی[40]
- نانو ذرات نوری[41]
صنعت
قویترین میکروسکوپ الکترونی
قویترین میکروسکوپ الکترونی دنیا با نام پیکو در سال ۲۰۰۹ در مدرسه عالی فنی آخن در آلمان ساخته شده و توان نمایش ذراتی به اندازه ۵۰ پیکومتر (پنج صدم نانومتر) و تصاویری از اجزای اتم و حرکت اتمها را دارد. این میکروسکوپ دو برابر دقیقتر از میکروسکوپیست که سال قبل در دانشگاه برکلی ساخته شده بود. میکروسکوپ الکترونی میتواند تصاویر سه بعدی از سطح سلولها فراهم آورد، اما انواعی از آن برای مشاهده سلولهای زنده کاربرد ندارند.
منابع
- Erni, Rolf; Rossell, MD; Kisielowski, C; Dahmen, U (2009). "Atomic-Resolution Imaging with a Sub-50-pm Electron Probe". Physical Review Letters. 102 (9): 096101. Bibcode:2009PhRvL.102i6101E. doi:10.1103/PhysRevLett.102.096101. PMID 19392535.
- Dannen, Gene (1998) Leo Szilard the Inventor: A Slideshow (1998, Budapest, conference talk). dannen.com.
- Mathys, Daniel, Zentrum für Mikroskopie, University of Basel: Die Entwicklung der Elektronenmikroskopie vom Bild über die Analyse zum Nanolabor, p. 8.
- Ruska, Ernst (1986). "Ernst Ruska Autobiography". Nobel Foundation. Retrieved 2010-01-31.
- "The Scale of Things". Office of Basic Energy Sciences, U.S. Department of Energy. 2006-05-26. Archived from the original on 2010-02-01. Retrieved 2010-01-31.
- O'Keefe MA; Allard LF (2004-01-18). "Sub-Ångstrom Electron Microscopy for Sub-Ångstrom Nano-Metrology" (PDF). Information Bridge: DOE Scientific and Technical Information – Sponsored by OSTI.
- Yoo, Inwan, David GC Hildebrand, Willie F. Tobin, Wei-Chung Allen Lee, and Won-Ki Jeong. "ssEMnet: Serial-section Electron Microscopy Image Registration using a Spatial Transformer Network with Learned Features" In Deep Learning in Medical Image Analysis and Multimodal Learning for Clinical Decision Support, pp. 249-257. Springer, Cham, 2017.
- "SPLEEM". National Center for Electron Microscopy (NCEM). Archived from the original on 2010-05-29. Retrieved 2010-01-31.
- Burgess, Jeremy (1987). Under the Microscope: A Hidden World Revealed. CUP Archive. p. 11. ISBN 978-0-521-39940-1.
- "Introduction to Electron Microscopy" (PDF). FEI Company. p. 15. Retrieved 12 December 2012.
- Antonovsky, A. (1984). "The application of colour to sem imaging for increased definition". Micron and Microscopica Acta. 15 (2): 77–84. doi:10.1016/0739-6260(84)90005-4.
- Danilatos, G.D. (1986). "Colour micrographs for backscattered electron signals in the SEM". Scanning. 9 (3): 8–18. doi:10.1111/j.1365-2818.1986.tb04287.x.
- Williams, R. C. ; Wyckoff, R. W. (1945-06-08). "Electron shadow micrography of the tobacco mosaic virus protein". Science. 101 (2632): 594–596. Bibcode:1945Sci...101..594W. doi:10.1126/science.101.2632.594. PMID 17739444.
- Juniper, B.E. ; Bradley, D.E. (1958). "The carbon replica technique in the study of the ultrastructure of leaf surfaces". Journal of Ultrastructure Research. 2 (1): 16–27. doi:10.1016/s0022-5320(58)90045-5.
- da Silva, Pedro Pinto; Branton, Daniel (1970-06-01). "Membrane splitting in freeze-etching". The Journal of Cell Biology. 45 (3): 598–605. doi:10.1083/jcb.45.3.598. PMC 2107921. PMID 4918216.
- Rash, J. E. ; Johnson, T. J. ; Hudson, C. S. ; Giddings, F. D. ; Graham, W. F. ; Eldefrawi, M. E. (1982-11-01). "Labelled-replica techniques: post-shadow labelling of intramembrane particles in freeze-fracture replicas". Journal of Microscopy. 128 (Pt 2): 121–138. doi:10.1111/j.1365-2818.1982.tb00444.x. PMID 6184475.
- de Jonge, N. ; Ross, F.M. (2011). "Electron microscopy of specimens in liquid". Nature Nanotechnology. 6 (8): 695–704. Bibcode:2003NatMa...2..532W. doi:10.1038/nmat944. PMID 12872162.
- Kasas, S. ; Dumas, G. ; Dietler, G. ; Catsicas, S. ; Adrian, M. (2003). "Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging". Journal of Microscopy. 211 (1): 48–53. doi:10.1046/j.1365-2818.2003.01193.x.
- Sabanay, I. ; Arad, T. ; Weiner, S. ; Geiger, B. (1991). "Study of vitrified, unstained frozen tissue sections by cryoimmunoelectron microscopy". Journal of Cell Science. 100 (1): 227–236. PMID 1795028.
- Adrian, Marc; Dubochet, Jacques; Lepault, Jean; McDowall, Alasdair W. (1984). "Cryo-electron microscopy of viruses". Nature (Submitted manuscript). 308 (5954): 32–36. Bibcode:1984Natur.308...32A. doi:10.1038/308032a0. PMID 6322001.
- Boehme, L. ; Bresin, M. ; Botman, A. ; Ranney, J. ; Hastings, J.T. (2015). "Focused electron beam induced etching of copper in sulfuric acid solutions". Nanotechnology. 26 (49): 495301. Bibcode:2015Nanot..26W5301B. doi:10.1088/0957-4484/26/49/495301. PMID 26567988.
- Kacher, J. ; Cui, B. ; Robertson, I.M. (2015). "In situ and tomographic characterization of damage and dislocation processes in irradiated metallic alloys by transmission electron microscopy". Journal of Materials Research. 30 (9): 1202–1213. Bibcode:2015JMatR..30.1202K. doi:10.1557/jmr.2015.14.
- Rai, R.S. ; Subramanian, S. (2009). "Role of transmission electron microscopy in the semiconductor industry for process development and failure analysis". Progress in Crystal Growth and Characterization of Materials. 55 (3–4): 63–97. doi:10.1016/j.pcrysgrow.2009.09.002.
- Morris, G.J. ; Goodrich, M. ; Acton, E. ; Fonseca, F. (2006). "The high viscosity encountered during freezing in glycerol solutions: Effects on cryopreservation". Cryobiology. 52 (3): 323–334. doi:10.1016/j.cryobiol.2006.01.003. PMID 16499898.
- von Appen, Alexander; Beck, Martin (May 2016). "Structure Determination of the Nuclear Pore Complex with Three-Dimensional Cryo electron Microscopy". Journal of Molecular Biology. 428 (10): 2001–10. doi:10.1016/j.jmb.2016.01.004. PMC 4898182. PMID 26791760.
- Florian, P.E. ; Rouillé, Y. ; Ruta, S. ; Nichita, N. ; Roseanu, A. (2016). "Recent advances in human viruses imaging studies". Journal of Basic Microbiology. 56 (6): 591–607. doi:10.1002/jobm.201500575. PMID 27059598.
- Cushnie, T.P. ; O’Driscoll, N.H. ; Lamb, A.J. (2016). "Morphological and ultrastructural changes in bacterial cells as an indicator of antibacterial mechanism of action". Cellular and Molecular Life Sciences. 73 (23): 4471–4492. doi:10.1007/s00018-016-2302-2. hdl:10059/2129. PMID 27392605.
- Li, M. -H. ; Yang, Y. -Q. ; Huang, B. ; Luo, X. ; Zhang, W. ; Han, M. ; Ru, J. -G. (2014). "Development of advanced electron tomography in materials science based on TEM and STEM". Transactions of Nonferrous Metals Society of China. 24 (10): 3031–3050. doi:10.1016/S1003-6326(14)63441-5.
- Li, W.J. ; Shao, L.Y. ; Zhang, D.Z. ; Ro, C.U. ; Hu, M. ; Bi, X.H. ; Geng, H. ; Matsuki, A. ; Niu, H.Y. ; Chen, J.M. (2016). "A review of single aerosol particle studies in the atmosphere of East Asia: morphology, mixing state, source, and heterogeneous reactions". Journal of Cleaner Production. 112 (2): 1330–1349. doi:10.1016/j.jclepro.2015.04.050.
- Sousa, R.G. ; Esteves, T. ; Rocha, S. ; Figueiredo, F. ; Quelhas, P. ; Silva, L.M. (2015). Automatic detection of immunogold particles from electron microscopy images. Image Analysis and Recognition. Lecture Notes in Computer Science. 9164. pp. 377–384. doi:10.1007/978-3-319-20801-5_41. ISBN 978-3-319-20800-8.
- erkins, G.A. (2014). "The Use of miniSOG in the Localization of Mitochondrial Proteins". Mitochondrial Function. Methods in Enzymology. 547. pp. 165–179. doi:10.1016/B978-0-12-801415-8.00010-2. ISBN 978-0-12-801415-8. PMID 25416358.
- hen, X.D. ; Ren, L.Q. ; Zheng, B. ; Liu, H. (2013). "Physics and engineering aspects of cell and tissue imaging systems: microscopic devices and computer assisted diagnosis". Biophotonics in Pathology: Pathology at the Crossroads. 185 (Biophotonics in Pathology): 1–22. doi:10.3233/978-1-61499-234-9-1. PMID 23542929.
- Fagerland, J.A. ; Wall, H.G. ; Pandher, K. ; LeRoy, B.E. ; Gagne, G.D. (2012). "Ultrastructural analysis in preclinical safety evaluation". Toxicologic Pathology. 40 (2): 391–402. doi:10.1177/0192623311430239. PMID 22215513.
- Heider, S. ; Metzner, C. (2014). "Quantitative real-time single particle analysis of virions". Virology. 462–463: 199–206. doi:10.1016/j.virol.2014.06.005. PMC 4139191. PMID 24999044.
- Tsekouras, G. ; Mozer, A.J. ; Wallace, G.G. (2008). "Enhanced performance of dye sensitized solar cells utilizing platinum electrodeposit counter electrodes". Journal of the Electrochemical Society. 155 (7): K124–K128. doi:10.1149/1.2919107.
- Besenius, P. ; Portale, G. ; Bomans, P.H.H. ; Janssen, H.M. ; Palmans, A.R.A. ; Meijer, E.W. (2010). "Controlling the growth and shape of chiral supramolecular polymers in water". Proceedings of the National Academy of Sciences of the United States of America. 107 (42): 17888–17893. Bibcode:2010PNAS..10717888B. doi:10.1073/pnas.1009592107. PMC 2964246. PMID 20921365.
- Furuya, K. (2008). "Nanofabrication by advanced electron microscopy using intense and focused beam". Science and Technology of Advanced Materials. 9 (1): Article 014110. Bibcode:2008STAdM...9a4110F. doi:10.1088/1468-6996/9/1/014110. PMC 5099805. PMID 27877936.
- Kosasih, Felix Utama; Ducati, Caterina (May 2018). "Characterising degradation of perovskite solar cells through in-situ and operando electron microscopy". Nano Energy. 47: 243–256. doi:10.1016/j.nanoen.2018.02.055.
- Maloy, Stuart A. ; Sommer, Walter F. ; James, Michael R. ; Romero, Tobias J. ; Lopez, Manuel R. ; Zimmermann, Eugene; Ledbetter, James M. (13 May 2017). "The Accelerator Production of Tritium Materials Test Program". Nuclear Technology. 132 (1): 103–114. doi:10.13182/nt00-a3132.
- Ukraintsev, Vladimir (27 February 2012). "Review of reference metrology for nanotechnology: significance, challenges, and solutions". Journal of Micro/Nanolithography, MEMS, and MOEMS. 11 (1): 011010. doi:10.1117/1.JMM.11.1.011010.
- Wilhelmi, O. ; Roussel, L. ; Faber, P. ; Reyntjens, S. ; Daniel, G. (June 2010). "Focussed ion beam fabrication of large and complex nanopatterns". Journal of Experimental Nanoscience. 5 (3): 244–250. Bibcode:2010JENan...5..244W. doi:10.1080/17458080903487448.
- Vogt, E.T.C. ; Whiting, G.T. ; Chowdhury, A.D. ; Weckhuysen, B.M. (2015). Zeolites and zeotypes for oil and gas conversion. Advances in Catalysis. 58. pp. 143–314. doi:10.1016/bs.acat.2015.10.001. ISBN 978-0-12-802126-2.
- Lai, Shih-En; Hong, Ying-Jhan; Chen, Yu-Ting; Kang, Yu-Ting; Chang, Pin; Yew, Tri-Rung (18 September 2015). "Direct-Writing of Cu Nano-Patterns with an Electron Beam". Microscopy and Microanalysis. 21 (6): 1639–43. Bibcode:2015MiMic..21.1639L. doi:10.1017/S1431927615015111. PMID 26381450.
- Sicignano, Angelo; Di Monaco, Rossella; Masi, Paolo; Cavella, Silvana (October 2015). "From raw material to dish: pasta quality step by step". Journal of the Science of Food and Agriculture. 95 (13): 2579–87. doi:10.1002/jsfa.7176. PMID 25783568.
- Brożek-Mucha, Zuzanna (2014). "Scanning Electron Microscopy and X-Ray Microanalysis for Chemical and Morphological Characterisation of the Inorganic Component of Gunshot Residue: Selected Problems". BioMed Research International. 2014: 428038. doi:10.1155/2014/428038. PMC 4082842. PMID 25025050.
- Carbonell-Verdu, A. ; Garcia-Sanoguera, D. ; Jorda-Vilaplana, A. ; Sanchez-Nacher, L. ; Balart, R. (2016). "A new biobased plasticizer for poly(vinyl chloride) based on epoxidized cottonseed oil". Journal of Applied Polymer Science. 33 (27): 43642. doi:10.1002/app.43642. hdl:10251/82834.
- Ding, Jie; Zhang, Zhiming (1 May 2015). "Micro-characterization of dissimilar metal weld joint for connecting pipe-nozzle to safe-end in generation III nuclear power plant". Acta Metall Sin. 51 (4): 425–39. doi:10.11900/0412.1961.2014.00299 (inactive 2019-08-19).
- Tsikouras, Basilios; Pe-Piper, Georgia; Piper, David J.W. ; Schaffer, Michael (June 2011). "Varietal heavy mineral analysis of sediment provenance, Lower Cretaceous Scotian Basin, eastern Canada". Sedimentary Geology. 237 (3–4): 150–165. Bibcode:2011SedG..237..150T. doi:10.1016/j.sedgeo.2011.02.011.
- Li, Xiang; Jiang, Chuan; Pan, Lili; Zhang, Haoyang; Hu, Lang; Li, Tianxue; Yang, Xinghao (15 July 2014). "Effects of preparing techniques and aging on dissolution behavior of the solid dispersions of NF/Soluplus/Kollidon SR: identification and classification by a combined analysis by FT-IR spectroscopy and computational approaches". Drug Development and Industrial Pharmacy. 41 (1): 2–14. doi:10.3109/03639045.2014.938080. PMID 25026247.

