سدیم کربنات
سدیم کربنات، Na2CO3 یک نمک سدیم است که از ترکیب آن با کربنیک اسید تولید میشود. همه اشکال آن نمکهای سفید و محلول در آب هستند که محلولهای قلیایی متوسطی را در آب تولید میکنند. این ماده بهطور سنتی از خاکستر گیاهانی که در خاکهای غنی از سدیم رشد میکنند استخراج میشدهاست. سدیم کربنات در مقادیر زیاد توسط فرایند سُلوی از سدیم کلرید و آهک تولید میشود.
| سدیم کربنات | |
|---|---|
 | |
 | |
 | |
دیگر نامها Soda ash | |
| شناساگرها | |
| شماره ثبت سیایاس | ۴۹۷-۱۹-۸ 6132-02-1 (decahydrate) |
| پابکم | ۱۰۳۴۰ |
| کماسپایدر | ۹۹۱۶ |
| UNII | 45P3261C7T |
| شمارهٔ ئیسی | 207-838-8 |
| ChEBI | CHEBI:29377 |
| ChEMBL | CHEMBL۱۸۶۳۱۴ |
| شمارهٔ آرتیئیسیاس | VZ4050000 |
| جیمول-تصاویر سه بعدی | Image 1 |
SMILES
| |
| |
| خصوصیات | |
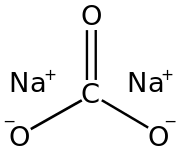
| فرمول مولکولی | Na2CO3 |
| جرم مولی | 105.9884 g/mol (anhydrous) 124.00 g/mol (monohydrate) 286.14 g/mol (decahydrate) |
| شکل ظاهری | White solid hygroscopic |
| بوی | Odorless |
| چگالی | 2.54 g/cm3 (anhydrous) 2.25 g/cm3 (monohydrate) 1.46 g/cm3 (decahydrate) |
| دمای ذوب | ۸۵۱ °C (anhydrous)[1] ۱۰۰ °C (decomp, monohydrate) ۳۴ °C (decomp, decahydrate) |
| دمای جوش | ۱۶۰۰ °C (anhydrous) |
| انحلالپذیری در آب | 70 g/L (0 °C) 216 g/L (20 °C)[1] 450 g/L (100 °C)[2] |
| انحلالپذیری | نامحلول در اتانول و استون |
| خاصیت بازی (pKb) | 3.67 |
| ضریب شکست (nD) | 1.495 (anhydrous) 1.420 (monohydrate) |
| ساختار | |
| trigonal planar | |
| خطرات | |
| MSDS | MSDS |
| شاخص ئییو | ۰۱۱-۰۰۵-۰۰-۲ |
| طبقهبندی ئییو | Irritant (Xi) |
| کدهای ایمنی | R۳۶ |
| شمارههای نگهداری | S۲, S۲۲, S26 |
| لوزی آتش | Error: imagemap_invalid_title |
| نقطه اشتعال | |
| ترکیبات مرتبط | |
| دیگر آنیونها | جوش شیرین |
| دیگر کاتیونها | لیتیوم کربنات پتاسیم کربنات کربنات روبیدیم کربنات سزیم |
| ترکیبات مرتبط | آمونیوم کربنات ناترون سدیم پرکربنات |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
کاربردها
عمده کاربرد سدیم کربنات در تولید شیشه است. چنانچه سدیم کربنات را در دماهای بسیار بالا حرارت دهیم، و آن را با ماسه و کلسیم کربنات ترکیب کنیم و سپس به سرعت آن را سرد کنیم، محصول ما شیشه خواهد بود.
سدیم کربنات همچنین به عنوان یک باز نسبتاً قوی در بسیاری از موارد به کار میرود. برای مثال، به عنوان تنظیمکننده PH جهت حفظ پایداری شرایط قلیایی لازم برای عملکرد اکثر عوامل تولیدکننده از این ترکیب استفاده میشود.
به عنوان یک افزودنی رایج در مخازن شهری جهت خنثیسازی اثر اسیدی کلر و افزایش PH به کار میرود. در آشپزی، گاهی اوقات به عنوان یک جایگزین برای سدیم هیدروکسید برای قلیایی کردن به خصوص در چوب شور (نان نمکی) به کار میرود. این خوراکها با یک محلول ماده قلیایی عمل آوری میشوند تا PH سطح ماده غذایی را تغییر کند که این سبب برشتگی بیشتر آن میشود.
در شیمی این ماده به عنوان یک الکترولیت استفاده میشود و این از آن جهت است که الکترولیتها معمولاً بازهای نمکی دارند و از طرفی سدیم کربنات به عنوان یک رسانای خوب در الکترولیز عمل میکند. همچنین به عنوان استاندارد اصلی تیتراسیون اسید و باز به کار میرود و این به دلیل پایداری جامد و گاز این ماده است که سبب سهولت در اندازهگیری دقیق تر جرم میشود.
در خانهها به عنوان نرمکنندهٔ آب در شستوشوی لباسها به کار میرود. این ماده با یونهای منیزیم و کلسیم موجود در آب سخت مقابله میکند و مانع از تشکیل پیوند بین آنها با ماده شوینده به کار رفته میشود. بدون استفاده از سدیم کربنات شوینده اضافی برای خیساندن یونهای منیزیم و کلسیم نیاز میشود. سدیم کربنات در بخش شویندهای فروشگاهها به نام علف شوره (اشنان) دیده میشود و بهطور مؤثری لکههای روغن، گریس، و الکل را از بین میبرد. سدیم کربنات همچنین به عنوان عامل ضد رسوبی از جمله رسوبهایی که در کتریها و ماشینهای بخار دیده میشود به کار میرود.
در کارگاههای آجرپزی از سدیم کربنات به عنوان عامل خمیرکننده استفاده میشود تا حجم آب مورد نیاز جهت قالبگیری خاک رس کاهش یابد. همچنین از آن برای تهیه فوری ماکارونی استفاده میشود.
سدیم کربنات یک افزودنی غذایی است (E500) که به عنوان تنظیمکننده میزان ترشی و نیز به عنوان پایدارکننده به کار میرود. سدیم کربنات همچنین در تولید بستنی چوبی کاربرد دارد. احساس خنکی و گازدار بودن نتیجهٔ واکنش گرماگیر بین سدیم کربنات و یک اسید ضعیف است (که معمولاً سیتریک اسید انتخاب میشود) و در نتیجهٔ آن کربن دیاکسید تولید میشود؛ یعنی زمانی که بستنی با بزاق دهان خیس میشود. سدیم کربنات همچنین برای از بین بردن کپک چوب یا سایر مواد به کار میرود.
شکلگیری
سدیم کربنات در آب محلول است. اما بهطور طبیعی در بخشهای خشک، به خصوص در رسوبهای معدنی شکل گرفته از تبخیر آب دریاچهها یافت میشود. رسوبات معدنی نمکهای قلیایی طبیعی، ترکیبی از سدیم کربنات و سدیم بی کربنات است که از کف دریاچههای خشک شده موجود در مصر از زمانهای گذشتهاستخراج میشدهاست تا در تهیه مومیایی و نیز ساخت ابتدایی شیشه استفاده شوند. سدیم کربنات به سه صورت ترکیب هیدراته شناخته شدهاست: سدیم کربنات ۲ آبه، سدیم کربنات ۷ آبه و سدیم کربنات تک آبه.
تولید
ترونا، یعنی تری سدیم هیدروژن دی کربنات دی هیدرات (Na3HCO3CO3·2H2O)، در مناطق مختلفی از ایالات متحده استخراج میشود و تمام سدیم کربنات نیاز آن کشور را تأمین میکند. رسوبات عظیم و طبیعی از آن در سال ۱۹۳۸ در نزدیکی Green River یافت شده و استخراج معادن در آمریکای شمالی بیشتر با توجه به جنبه اقتصادی و نه تولید صنعتی صورت گرفت. این ماده از دریاچههای قلیایی نیز به دست میآید، همچون دریاچهٔ Magadi در کنیا که البته با استفاده از فرایند لایروبی از روشهای ابتدایی به دست میآید و بهطور طبیعی تجدید میشود و بنابراین هیچگاه این منبع طبیعی پایان نمیپذیرد.
بسیاری از گیاهان شورپسند که در آبهای شور زیست میکنند و در مقابل آب شور مقاومند میتوانند انواع ناخالص سدیم کربنات را به ما بدهند و این منابع شکل رایج و کنونی مورد استفاده در اروپا و سایر مناطق تا قرن ۱۹ بود. گیاهان خشکی زی مانند درخت آشنا و نیز علف شوره یا خزه یا نوعی جلبک دریایی به نام کتانجک ابتدا جمعآوری شده و پس از خشک کردن سوزانده میشدند. خاکستر حاصل با آب شسته میشد تا محلول قلیایی تشکیل شود. این محلول پی از جوشانده شدن و خشک شدن محصول نهایی را به ما میدهد که Soda Ash نامیده میشود. این نام قدیمی برگرفته از منبع اولیه گیاهی آن است که یک بوته یک ساله به نام Salsola soda (barilla plant) است. غلظت سدیم کربنات موجود در Soda Ash بازه گستردهای دارد، از ۳–۲٪ موجود در کتانجک تا ۳۰٪ موجود در بهترین “barilla” که از گیاهان علف شوره موجود در اسپانیا به دست میآید. منابع گیاهی و جلبک مورد استفاده برای Soda Ash، و نیز برای پتاسهای قلیایی مرتبط، بهطور افزایندهای تا پایان قرن ۱۸ ناکافی به نظر میرسیدند و جستجو برای یافتن راههای تجاری و پایدار برای ساخت و سنتز این ماده از نمکها و سایر مواد شیمیایی روز به روز گسترش مییافت.
فرایند Leblanc
در سال ۱۷۹۱، شیمیدان فرانسوی نیکلاس لبلنک روشی نوین را برای تولید سدیم کربنات از نمک، سولفوریک اسید، و زغال سنگ به ثبت رساند. نخست نمک دریایی (سدیم کلرید) در سولفوریک اسید جوشانده میشد تا سدیم سولفور و گاز هیدروژن کلرید تولید شود. همچنان که در واکنش زیر مشاهده میکنید. 2nacl+… سپس، مخلوط سدیم سولفات با سنگ آهک خرد شده (کلسیم کربنات) و زغال حرارت داده میشد تا سدیم کربنات به همراه کربن دیاکسید و کلسیم سولفور حاصل شود.
سدیم کربنات از عصارهگیری خاکستر و آب به دست میآمد، و با تبخیر آب موجود، جمعآوری میشد. هیدروکلریک اسید حاصل از فرایند لبلنک، یکی از منابع اصلی آلودگی هوا است و کلسیم سولفید که به عنوان یک محصول جانبی تلقی میشود یک فراورده بیهوده میباشد. البته با این توصیفات، روش اصلی تولید سدیم کربنات تا اواخر دههٔ ۱۸۸۰ همین روش یادشده بود.[3][4]
فرایند سولوِی (Solvay)
در سال ۱۸۶۱، یکی از شیمیدانان صنایع بلژیک، ارنست سولوی، روشی را معرفی کرد که سدیم کلرید با استفاده از آمونیاک به سدیم کربنات تبدیل میشود. این فرایند در یک برج بزرگ میان تهی صورت میگیرد و در انتهای این برج کلسیم کربنات (سنگ آهک) حرارت داده میشود تا کربن دیاکسید به دست آید:
و از قسمت بالای برج، محلول غلیظی از سدیم کلرید و آمونیک وارد آن میشود. به محض این که در میان آن کربن دیاکسید بجوشد، سدیم بی کربنات تهنشین میشود:
سپس سدیم بی کربنات با حرارت دادن در شکل سدیم کربنات ظاهر میشود و آب و کربن دیاکسید سایر فراوردهها را تشکیل میدهند. ضمناً، آمونیاک از فراورده جانبی آمونیوم کلرید مجدداً تولید میشود و این زمانی رخ میدهد که در مجاورت آهک (کلسیم هیدروکسید) باقیمانده از واکنش تولید کربن دی کسید قرار گیرد.
به این دلیل که فرایند سولوای آمونیاک مصرف شده را بازمیگرداند و تنها آب شور و آهک طی آن به مصرف میرسد و تنها فراوردهٔ اضافی آن کلسیم کلرید است، اساساً از نظر اقتصادی نسبت به فرایند لبلنک برتری دارد و به سرعت در تولیدات سدیم کربنات به عنوان روشی اصلی و کارامد مطرح شد. تا سال ۱۹۰۰، ۹۰٪ سدیم کربنات تحت این فرایند تولید شد و آخرین پایگاه تولید سدیم کربنات که با استفاده از روش قبلی یعنی روش لبلنک فعالیت میکرد، در آغاز دههٔ ۱۹۲۰ بسته شد.
فرایند Hou
توسط شیمیدان چینی به نام Hou Debang در دههٔ ۱۹۳۰ معرفی شد. این فرایند در مراحل اولیه مشابه فرایند سولوای است. اما به جای واکنش دادن محلول باقیمانده با آهک، کربن دیاکسید و آمونیاک یک محلول تشکیل میدهند و سدیم کلرید هنگامی که دما به حد ۴۰ درجه سانتیگراد رسید به محلول اضافه میشود. سپس محلول تا ۱۰ درجه سانتیگراد سرد میشود. آمونیوم کلرید تهنشین شده و با فیلترگذاری جدا میشود؛ و در ادامه محلول مجدداً برای تولید سدیم بی کربنات به کار گرفته میشود. این روش مشکل تولید کلسیم کلرید را حل کرده و از محصول جانبی آمونیوم کلریدnh4cl) نیز جهت کود دهی استفاده میشود. این روش، روش روز تولید سدیم کربنات در صنایع کنونی جهان است.
جستار های وابسته
منابع
- "Sodium Carbonate" (PDF). UNEP Publications. Archived from the original (PDF) on 15 September 2011. Retrieved 29 November 2011.
- «نسخه آرشیو شده». بایگانیشده از اصلی در ۲۴ فوریه ۲۰۱۳. دریافتشده در ۲۹ نوامبر ۲۰۱۱.
- ^ a b Clow, Archibald and Clow, Nan L. (1952). Chemical Revolution, (Ayer Co Pub, June 1952), pp. 65–90. ISBN 0-8369-1909-2.
- ^ Kiefer, David M. (200 s2). "It was all about alkali," Today's Chemist at Work, Vol. 11, No. 1, pp. 45–6.