دگرشکلیهای آهن
در فشار اتمسفریک، سه دگرشکل از آهن وجود دارد، آهن آلفا (α-Fe)، آهن گاما (γ-Fe)، و آهن دلتا (δ-Fe). در فشارهای بسیار بالا دگرشکل چهارمی هم به نام آهن اپسیلون (ε-Fe) وجود دارد. برخی از شواهد تجربی بحث برانگیز نشان میدهند که دگرشکل پنجمی وجود دارد که در دماها و فشارهای بسیار بالا پایدار است.[1]
.svg.png.webp)
دلیل اهمیت فازهای مختلف آهن در فشار اتمسفریک، تفاوت در انحلالپذیری کربن است که باعث به وجود آمدن انواع مختلف فولاد میشود. فازهای فشار بالای آهن به عنوان مدل برای بخشهای جامد هستههای سیارات مهم هستند. به طور کلی فرض میشود که هستهی درونی زمین از یک آلیاژ کریستالی آهن و نیکل با ساختار اپسیلون (ε) تشکیل شده باشد. [2][3][4] اعتقاد بر این است که هستهی بیرونی که اطراف هستهی جامد درونی است، از آهن مایع مخلوط شده با نیکل و مقدار کمی از عناصر سبک تشکیل شده است.
دگرشکلهای فشار استاندارد
آهن آلفا (α-Fe)
در دماهای پایینتر از ۹۱۲ درجه سانتیگراد، آهن دارای ساختار مکعبی مرکزپر (BCC) است و به عنوان آهن آلفا یا فریت شناخته میشود. این دگرشکل از نظر ترمودینامیکی پایدار است و نسبتاً نرم است. آهن آلفا میتواند تحت فشار حداکثر ۱۵ گیگاپاسکال قرار گیرد و پس از آن به یک فرم فشار بالا به نام آهن اپسیلون تبدیل میشود که ساختار بسته شش ضلعی (HCP) دارد.
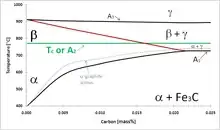
از نظر مغناطیسی، آهن آلفا در دماهای بالا پارامغناطیس است. با این حال، با خنک شدن آن تا دما ۷۷۱ درجه سانتیگراد، [5] که دمای کوری (TC) آهن است، فرومغناطیس میشود. عکس این حالت نیز اتفاق میافتد؛ همان طور که دمای آهن آلفا از دمای کوری بالاتر میرود، برانگیختگی حرارتی تصادفی اتمهای آهن از گشتاور مغناطیسی جهتدار الکترونهای جفت نشده بیشتر می شود و پارامغناطیس می شود.[6] در گذشته، فرم پارامغناطیس آهن آلفا به عنوان آهن بتا (β-Fe) شناخته میشد.[7][8] با این حال، این اصطلاح منسوخ و گمراه کننده است، زیرا با عبور آهن از دمای کوری، حوزههای مغناطیسی همسو میشوند ولی هیچ تغییری در ساختار رخ نمیدهد. آهن بتا از نظر کریستالوگرافی مشابه آهن آلفا است، و تنها تفاوتها در حوزههای مغناطیسی و پارامتر شبکهی شبکه مکعبی مرکزپر (BCC) منبسط شده به عنوان تابعی از دما است. بنابرین این دگرشکل در عملیات حرارتی فولاد از اهمیت کمی برخوردار است. به همین دلیل، فاز بتا معمولاً نه به عنوان یک فاز مشخص، بلکه صرفاً به عنوان انتهای دمای بالای میدان فاز آلفا در نظر گرفته میشود. خط A2 مرز بین میدانهای آهن آلفا و بتا را در دیاگرام فازی شکل ۱ نشان میدهد.
به همین ترتیب، A2 در مقایسه با دماهای بحرانی A1 (یوتکتوئید)، A3 و Acm از اهمیت کمی برخوردار است. Acm، جایی که آستنیت با سمنتیت + آهن گاما در تعادل ترمودینامیکی است، در شکل ۱ راستتر از لبهی راست نمودار است. میدان فاز آهن آلفا + گاما، در واقع همان میدان بتا + گاما بالای A2 است.
فاز اولیه فولاد کم کربن یا نرم و بیشتر چدنها در دمای اتاق، آهن آلفای فرومغناطیس است.[9][10] سختی آن تقریبا ۸۰ برینل است.[11][12] حداکثر انحلالپذیری کربن در آن در حدود ۰.۰۲ درصد وزنی در دمای ۷۲۷ درجه سانتیگراد و ۰.۰۰۱ درصد وزنی در دمای ۰ درجه سانتیگراد است.[13] وقتی که اتمهای کربن در آهن حل میشوند، حفرههای بینابینی را اشغال میکنند. اتمهای کربن که حدود دو برابر قطر حفرههای تتراهدرال (چهاروجهی) در ساختار آهن هستند، یک میدان کرنشی قوی را ایجاد میکنند.
فولاد نرم (فولاد کربنی با حداکثر ۰.۲ درصد وزنی کربن) بیشتر از آهن آلفا و مقادیر فزایندهی سمنتیت ( کاربید آهن، Fe3C) تشکیل شده است. این مخلوط یک ساختار لایهای به نام پرلیت به خود میگیرد. از آن جا که بینیت و پرلیت هر دو شامل آهن آلفا میباشند، در صورت رسیدن به تعادل در دمای اتاق، هر آلیاژ آهن-کربن حاوی مقداری آهن آلفا خواهد بود. مقدار آهن آلفا به روند خنکسازی بستگی دارد.
آهن گاما (γ-Fe)
با سرد شدن آهن تا دمای ۱۳۹۴ درجه سانتیگراد، ساختار کریستالی آن به ساختار مکعبی وجوهپر (FCC) تغییر میکند. در این شکل به آن آهن گاما یا آستنیت گفته میشود. آهن گاما میتواند به میزان قابل توجهی بیشتر کربن را در خود حل کند (تا مقدار ۲.۰۴ درصد وزنی در دمای ۱۱۴۶ درجه سانتیگراد). این فرم اشباع کربن در فولاد گاما در فولاد ضدزنگ دیده میشود.
آهن دلتا (δ-Fe)
وقتی آهن مذاب خنک میشود، در دمای ۱۵۳۸ درجه سانتیگراد به دگرشکل دلتا که دارای ساختار مکعبی مرکزپر (BCC) است، تبدیل میشود.[14] آهن دلتا میتواند تا حداکثر ۰.۰۸ درصد وزنی کربن را در دمای ۱۴۷۵ درجه سانتیگراد در خود حل کند.
دگرشکلهای فشار بالا
آهن اپسیلون / هگزافروم (ε-Fe)
در فشارهای بالاتر از تقریبا ۱۰ گیگاپاسکال و دماهای چند صد کلوین یا کمتر، ساختار آهن آلفا به یک ساختار بسته شش ضلعی (HCP) تبدیل میشود که به عنوان آهن اپسیلون یا هگزافروم شناخته میشود.[15] آهن گاما با دمای بالاتر نیز میتواند به آهن اپسیلون تبدیل شود، اما این کار را در فشارهای بالاتر انجام میدهد. خاصیت ضدفرومغناطیسی در آلیاژهای آهن اپسیلون با منگنز، اسمیم و روتنیم مشاهده شده است.[16]
دما و فشار بالای تجربی
یک فرم پایدار دیگر، در صورت وجود، ممکن است در فشارهای حداقل ۵۰ گیگاپاسکال و دماهای حداقل ۱۵۰۰ کلوین ظاهر شود. تصور میشود که این فرم دارای ساختار راستلوزی (اورتورومبیک) یا ساختار بسته شش ضلعی (HCP) دوتایی باشد.[1]
استحالههای فازی
نقاط ذوب و جوش
نقطه ذوب آهن به طور تجربی برای فشارهای کمتر از ۵۰ گیگاپاسکال کاملا مشخص شده است.
برای فشارهای بیشتر، دادههای منتشر شده نقطه سهگانه گاما-اپسیلون-مایع را در فشارهایی قرار میدهند که دهها گیگاپاسکال و ۱۰۰۰ کلوین در نقطه ذوب تفاوت دارند. به طور کلی، شبیهسازی کامپیوتری دینامیک مولکولی از آزمایشهای ذوب آهن، نقاط ذوب بالاتر و شیبهای بسیار تیزتر منحنی ذوب نسبت به آزمایشهای استاتیک انجام شده در سلولهای سندان الماس را نشان میدهند.[17]
نقاط ذوب و جوش آهن، و همچنین آنتالپی اتمی شدن آن، کمتر از این مقادیر برای عناصر قبلی دسته 3d از اسکاندیم تا کروم است. این موضوع نشاندهندهی این است که سهم الکترونهای دسته 3d در پیوند اتمی با جذب بیشتر به سمت هستهی اتم، کم میشود.[18] با این حال، آنها بالاتر از این مقادیر برای عنصر قبلی، منگنز هستند، زیرا این عنصر دارای زیرلایه نیمه پر 3d است و در نتیجه الکترونهای زیرلایه d آن به راحتی نامتمرکز نمیشوند. این موضوع در روتنیم نیز تکرار میشوند ولی در اسمیم این گونه نیست.[19]
استحالههای فازی ساختاری
دمای دقیقی که در آن آهن از یک ساختار کریستالی، به یک ساختار کریستالی دیگر تبدیل میشود به این بستگی دارد که چه مقدار و چه نوع عناصر دیگری در آن حل شدهاند. مرز بین فازهای مختلف جامد آهن روی دیاگرامهای فازی ترسیم میشود که معمولا به صورت دما در برابر درصد وزنی آهن رسم میشوند. افزودن بعضی عناصر مانند کروم، دامنهی دما را برای فاز گاما کم میکند، در حالی که بعضی دیگر دامنهی دمای فاز گاما را افزایش میدهند. در عناصری که دامنه فاز گاما را کاهش میدهند، مرز فازهای آلفا و گاما به مرز فازهای گاما و دلتا متصل میشود و آنچه را که معمولا حلقهی گاما نامیده میشود، تشکیل میدهد. افزودن افزودنیهایی که حلقهی گاما را ایجاد میکنند، آهن را در یک ساختار مکعبی مرکزپر (BCC) نگه میدارد و از استحاله فولاد به سایر حالتهای جامد جلوگیری میکند.[20]
منابع
- Boehler, R. (2000). "High-pressure experiments and the phase diagram of lower mantle and core materials". Reviews of Geophysics. 38 (2): 221–245. doi:10.1029/1998RG000053. ISSN 1944-9208.
- Cohen, Ronald; Stixrude, Lars. "Crystal at the Center of the Earth". Archived from the original on 5 February 2007. Retrieved 2007-02-05.
- Stixrude, Lars; Cohen, R. E. (1995-03-31). "High-Pressure Elasticity of Iron and Anisotropy of Earth's Inner Core". Science. 267 (5206): 1972–1975. doi:10.1126/science.267.5206.1972. ISSN 0036-8075. PMID 17770110.
- "What is at the centre of the Earth?". BBC News. 31 August 2011.
- Alloy Phase Diagrams. ASM Handbook. 3. ASM International. 1992. pp. 2.210, 4.9. ISBN 978-0-87170-381-1.
- Cullity, B.D.; Graham, C.D. (2009). Introduction to Magnetic Materials (2nd ed.). IEEE. p. 91. ISBN 978-0-471-47741-9.
- D. K. Bullens et al., Steel and Its Heat Treatment, Vol. I, Fourth Ed., J. Wiley & Sons Inc., 1938, p. 86.
- Avner, S.H. (1974). Introduction to physical metallurgy (2nd ed.). McGraw-Hill. p. 225. ISBN 978-0-07-002499-1.
- Maranian, Peter (2009), Reducing Brittle and Fatigue Failures in Steel Structures, New York: American Society of Civil Engineers, ISBN 978-0-7844-1067-7.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Structure of plain steel, retrieved 2008-10-21.
- Alvarenga, Henrique Duarte; De Putte, Tom Van; Van Steenberge, Nele; Sietsma, Jilt; Terryn, Herman (2015-01-01). "Influence of Carbide Morphology and Microstructure on the Kinetics of Superficial Decarburization of C-Mn Steels". Metallurgical and Materials Transactions A. 46 (1): 123–133. doi:10.1007/s11661-014-2600-y. ISSN 1543-1940.
- Smith & Hashemi 2006, p. 363.
- Lyman, Taylor, ed. (1973). Metallography, Structures and Phase Diagrams. Metals Handbook. 8 (8th ed.). Metals Park, Ohio: ASM International. OCLC 490375371.
- Mathon, O.; Baudelet, F.; Itié, J. P.; Polian, A.; d'Astuto, M.; Chervin, J. C.; Pascarelli, S. (2004-12-14). "Dynamics of the Magnetic and Structural $\ensuremath{\alpha}\mathrm{\text{\ensuremath{-}}}\ensuremath{\epsilon}$ Phase Transition in Iron". Physical Review Letters. 93 (25): 255503. doi:10.1103/PhysRevLett.93.255503.
- G. C. Fletcher; R. P. Addis (November 1974). "The magnetic state of the phase of iron" (PDF). Journal of Physics F: Metal Physics. 4 (11). p. 1954. Bibcode:1974JPhF....4.1951F. doi:10.1088/0305-4608/4/11/020. Retrieved December 30, 2011.
- "Properties of Rocks and Minerals – High-Pressure Melting". 2007-01-01: 527–541. doi:10.1016/B978-044452748-6.00047-X.
- Greenwood and Earnshaw, p. 1116
- Greenwood and Earnshaw, pp. 1074–75
- Myer Kurz, ed. (2002-07-22). Handbook of Materials Selection. p. 44. ISBN 9780471359241. Retrieved December 19, 2013.
