ترکیبات کربن
ترکیبات کربن به عنوان مواد شیمیایی حاوی کربن تعریف میشوند.[1][2] ترکیبات کربن بیشتری نسبت به سایر عناصر شیمیایی به جز هیدروژن وجود دارد. ترکیبات آلی کربن بسیار بیشتر از ترکیبات کربن معدنی هستند. بطور کلی پیوندهای کربن با عناصر دیگر پیوندهای کووالانسی هستند. کربن ظرفیت بالایی دارد اما رادیکالهای آزاد کربن و کاربنها به عنوان واسطههای کوتاه مدت ظاهر میشوند. یونهای کربن، کربوهیدرات هستند و کربانیونها نیز طول عمر کوتاهی دارند. تشکیل حلقه و زنجیر از مهمترین خواص کربن است.[3]
ترکیبات آلی
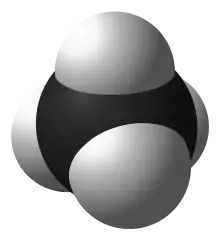
کربن توانایی تشکیل زنجیرهای طولانی و متقاطع متشکل از پیوندهای کربن-کربن را دارد، خصلتی که به آن کاتناسیون[lower-alpha 1][توضیح 1] گفته میشود. پیوندهای کربن-کربن پیوندهایی محکم و پایدار هستند و از طریق کاتناسیون این پیوندها میتوانند ترکیبات کربنی بیشماری را تشکیل دهند.[4]
ترکیبات معدنی
بهصورت معمول، ترکیبات حاوی کربن که ترکیباتی معدنی تلقی میشوند، فاقد پیوند کربن-کربن، کربن-هیدروژن و کربن-هالوژن هستند و در طبقهای کاملاً جدا نسبت به ترکیبات آلی قرار میگیرند. البته تعریف ارائه شده کاملاً سختگیرانه نیست و ممکن است طبقهبندی آلی و معدنی برای بعضی از ترکیبات بسته به دیدگاه یک پژوهشگر، کمی متفاوت باشد. یک دسته از ترکیبات کربنی معدنی، اکسیدهای ساده کربن هستند. برجستهترین ترکیب از خانواده اکسیدهای کربنی، کربن دیاکسید است، مولکولی که در تاریخ گذشته زمین جزء اصلی جو زمین بودهاست، اما امروزه تبدیل به جزئی ناچیز از آن شدهاست.[5] زمانی که کربن دیاکسید در آب حل میشود منجر به تولید کربنیک اسید میشود، اما همانند اغلب ترکیبات دارای چندین پیوند یگانه اکسیژن متصل به یک اتم کربن، ناپایدار است و به مرور تجریه میشود.[6] با اینحال اسید کربنیک قادر به تولید ساختار کربنات (CO۳) است که از طریق عدم استقرار الکترون میان کربن مرکزی و اکسیژنهای متصل به آن، پایدار میشود. کلسیت از جمله مواد معدنی مهمی است که حاوی گروه کربنات است. کربن دیسولفید نیز مشابه کربنات است با اینحال، بهعلت خواص فیزیکی و همچنین کاربرد آن در سنتز ترکیبات آلی، معمولاً از آن بهعنوان یک حلال آلی یاد میشود.[7]
ترکیبات کربن و نیتروژن
ترکیبات معدنی کربن نیتروژن شامل سیانوژن، هیدروژن سیانید، سیانامید، اسید ایزوسیانیک و سیانوژن کلرید است.
| ترکیب بندی | جرم مولی (گرم در مول) | دمای جوش درجه سانتی گراد | نقطه ذوب درجه سانتی گراد | ||
| سیانوژن | (CN) 2 | ۵۲٫۰۳ | −۲۱ | −۲۸ | |
| سیانید هیدروژن | HCN | ۲۷٫۰۳ | ۲۵–۲۶ | −۱۲ - -۱۴ | |
| سیانامید | CN 2 H 2 | 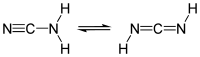 |
۴۲٫۰۴ | ۲۶۰ (تجزیه) | ۴۴ |
| ایزوسیانیک اسید | HNCO | ۴۳٫۰۳ | ۲۳٫۵ | −۸۶ | |
| کلرید سیانوژن | CNCl | ۶۱٫۴۷ | ۱۳ | ۶ پوند | |
| کلروسولفونیل ایزوسیانات | CNClO 3 S | 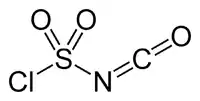 |
۱۴۱٫۵۳ | ۱۰۷ | −۴۴ |
| کلرید سیانوریک | (NCCl) 3 | 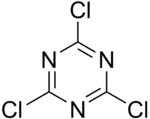 |
۱۸۴٫۴۱ | ۱۹۲ | ۱۵۴ |
| کربن و ترکیبات ازت معدنی | |||||
ترکیبات آلی فلزی
ترکیبات آلی فلزی بر اساس تعریف به مولکولهای گفته میشود که حداقل حاوی یک پیوند کربن-فلز باشند. گستره وسیعی از چنین ترکیباتی وجود دارد که ترکیبات ساده آلکیل-فلز (مانند تترااتیلسرب)، η۲-آلکان (مانند نمک زایس)، η۳-آلیل (مانند دیمر آلیلپالادیم کلرید)، متالوسنهای حاوی لیگاندهای سیکلوپنتادیانیل (مانند فروسن) و کمپلکسهای کاربنی فلزات واسطه از مهمترین مجموعههای این طیف وسیع هستند. ترکیبات فلزی زیادای دارای لیگاند کربونیل و سیانید (مانند نیکل تتراکربونیل و پتاسیم فریسیانید) وجود دارد که برخی از آنها چنانچه فاقد سایر گروههای کربنی باشند، ترکیباتی کاملاً معدنی میدانند و آنها را در خانواده آلی فلزی قرار نمیدهند. با اینحال اغلب شیمیدانهای متخصص در زمینه شیمی آلی فلزی، کمپلکسهای فلزی، حتی مواردی که حاوی کربن معدنی هستند (مانند کربونیلها، سیانیدها و برخی از انواع کاربیدها و استیلیدها) را ذاتاً ترکیباتی آلی فلزی میدانند. اغلب کمپلکسهای حاوی لیگاندهای آلی که فاقد پیوند کربن-فلز از نوع کووالانسی هستند (مانند کمپلکسهای فلز-کربوکسیلاتها) اصطلاحاً آلی فلزی خوانده میشوند
کربوران
کربوران خوشه ای است که از اتمهای بور و کربن تشکیل شدهاست. مانند H 2 C 2 B 10 H 10 . . . .
آلیاژ
صدها آلیاژ وجود دارد که حاوی کربن هستند. متداولترین این آلیاژها، فولاد است که گاهی به آن " فولاد کربنی " نیز میگویند (رده:فولادها را ببینید).
توضیحات
- در شیمی، کاتناسیون به خصلتی گفته میشود که اتمهای یکسان با یکدیگر پیوند برقرار کنند و تشکیل یک سری یا زنجیره از پیوندهای متشکل از اتمهای یکسان را بدهند.
واژهنامه
- Catenation
منابع
- Organic Chemistry by Abraham William Simpson
- Encyclopedia of Inorganic Chemistry Bruce King Ed. Second Edition
- Advanced Inorganic Chemistry Cotton, F. Albert / Wilkinson, Geoffrey
- Burrows, A.; Holman, J.; Parsons, A.; Pilling, G.; Price, G. (2017). Chemistry3: Introducing Inorganic, Organic and Physical Chemistry. Oxford University Press. p. 70. ISBN 978-0-19-873380-5. Archived from the original on 2017-11-22. Retrieved 2017-05-07.
- Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (1982). "The prebiological paleoatmosphere: stability and composition". Origins of Life and Evolution of Biospheres. 12 (3): 245–259. Bibcode:1982OrLi...12..245L. doi:10.1007/BF00926894. PMID 7162799.
- Loerting, T.; et al. (2001). "On the Surprising Kinetic Stability of Carbonic Acid". Angew. Chem. Int. Ed. 39 (5): 891–895. doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E. PMID 10760883.
- "Carbon disulfide - an overview | ScienceDirect Topics". www.sciencedirect.com. Archived from the original on 9 May 2020. Retrieved 2018-03-07.

