MMP1
متالوپروتئیناز ۱ ماتریکس (انگلیسی: Matrix metalloproteinase-1) که با نامهای کلاژناز رودهای و کلاژناز فیبروبلاست هم شناخته میشود، یک آنزیم است که در انسان توسط ژن «MMP1» کُدگذاری میشود.[4][5][6] که بر روی بازوی بلند کروموزوم شماره ۱۱ قرار دارد.[4]
این آنزیم، نخستین کلاژناز مهرهداران بود که خالصسازی (بهصورت پروتئین) و همسانسازی (به عنوان یک دیانای مکمل) شد.[7][8]
این آنزیم در تجزیهٔ ماتریکس برونیاختهای در جریان فرایندهای طبیعی بدن همچون رشد و تکامل جنین، شکلدهی بافتی و هچنین برخی فرایندهای غیرعادی همچون آرتریت و متاستاز نقش دارد. «متالوپروتئیناز ۱ ماتریکس» بهویژه در تجزیهٔ کلاژن نوع ۱، ۲ و ۳ نقش مهمی دارد.
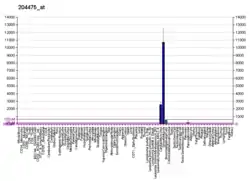
 القای «متالوپروتئیناز ۱ ماتریکس» در قرنیهٔ موش توسط سیپروفلوکساسین، افلوکساسین و لووفلوکساسین (b،c،d) در مقایسه با اشک مصنوعی (a). رویگلیو و همکاران، ۲۰۰۳ |
فشارهای مکانیکی احتمالاً در افزایش بیان این آنزیم در سلولهای لیگامان لثهای نقش دارند.[9]
این آنزیم با اینتگرین آلفا ۲ تعامل پروتئین-پروتئین دارد.[10][11]
منابع
- GRCm38: Ensembl release 89: ENSMUSG00000043089 - Ensembl, May 2017
- "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- آنتره 4312
- Brinckerhoff CE, Ruby PL, Austin SD, Fini ME, White HD (February 1987). "Molecular cloning of human synovial cell collagenase and selection of a single gene from genomic DNA". J. Clin. Invest. 79 (2): 542–6. doi:10.1172/JCI112845. PMC 424122. PMID 3027129.
- Pendás AM, Santamaría I, Alvarez MV, Pritchard M, López-Otín C (October 1996). "Fine physical mapping of the human matrix metalloproteinase genes clustered on chromosome 11q22.3". Genomics. 37 (2): 266–8. doi:10.1006/geno.1996.0557. PMID 8921407.
- Gross J, Lapiere CM (June 1962). "Collagenolytic activity in amphibian tissues: a tissue culture assay". Proc. Natl. Acad. Sci. U.S.A. 48 (6): 1014–22. doi:10.1073/pnas.48.6.1014. PMC 220898. PMID 13902219.
- Goldberg GI, Wilhelm SM, Kronberger A, Bauer EA, Grant GA, Eisen AZ (May 1986). "Human fibroblast collagenase. Complete primary structure and homology to an oncogene transformation-induced rat protein". J. Biol. Chem. 261 (14): 6600–5. PMID 3009463.
- Huang SF, Li YH, Ren YJ, Cao ZG, Long X (August 2008). "The effect of a single nucleotide polymorphism in the matrix metalloproteinase-1 (MMP-1) promoter on force-induced MMP-1 expression in human periodontal ligament cells". Eur. J. Oral Sci. 116 (4): 319–23. doi:10.1111/j.1600-0722.2008.00552.x. PMID 18705799.
- Stricker TP, Dumin JA, Dickeson SK, Chung L, Nagase H, Parks WC, Santoro SA (August 2001). "Structural analysis of the alpha(2) integrin I domain/procollagenase-1 (matrix metalloproteinase-1) interaction". J. Biol. Chem. 276 (31): 29375–81. doi:10.1074/jbc.M102217200. PMID 11359774.
- Dumin JA, Dickeson SK, Stricker TP, Bhattacharyya-Pakrasi M, Roby JD, Santoro SA, Parks WC (August 2001). "Pro-collagenase-1 (matrix metalloproteinase-1) binds the alpha(2)beta(1) integrin upon release from keratinocytes migrating on type I collagen". J. Biol. Chem. 276 (31): 29368–74. doi:10.1074/jbc.M104179200. PMID 11359786.
- مشارکتکنندگان ویکیپدیا. «MMP1». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۹ دسامبر ۲۰۱۸.