چسبندگی
چسبندگی (به انگلیسی: Adhesion) تمایل دو یا چند ماده ناهمنوع برای قرارگیری در کنار یکدیگر گفته میشود. این فرایند را نباید با پیوستگی (به انگلیسی: Cohesion) که تمایل کنارهم قرارگیری ماده همجنس است، اشتباه گرفت. تفاوت دگرچسبی و همچسبی در همجنس یا غیر همجنس بودن ذرات یا صفحات است. دگرچسبی و همچسبی ویژگیهای ذاتی مواد و ناشی از شکل و ساختار مولکولها و توزیع الکترونهای آن ماده هستند. نیروهای بین مولکولی شامل نیرو واندروالسی و پیوند هیدروژنی، عمدهترین عامل رخ دادن دگرچسبی و همچسبی هستند. علاوه بر نیروهای بین مولکولی، اثرات مکانیکی هم در به وجودآمدن آنها نقش دارند.

سازوکار چسبندگی
چسبندگی مکانیکی
چسبندگی مکانیکی سازوکاری شبیه سازوکار کشش سطحی دارد. سطحهای دو ماده درهمرفتگی فیزیکی دارند.
چسبندگی شیمیایی
چسبندگی شیمیایی هنگامی رخ میدهد که پیوند شیمیای بین دو سطح برقرار شود. تواناترین پیوند یونی و کوالانس است. اگر در یک سو هیدروژن و در سوی دیگر نیتروژن، اکسیژن یا فلوئور وجود داشته باشد، پیوند کمزور هیدروژنی ایجاد خواهد شد.
چسبندگی فیزیکی
در چسبندگی فیزیکی (Dispersive adhesion یا Physisorption) جذب فیزیکی دو ماده به وسیلهٔ نیروهای واندروالسی است. سازوکار اینگونه چسبندگی بر پایه وجود قطبش در اتمها و مولکولها است که در آنها قطبهای مثبت و منفی به وجود میآورد و این قطبها با ربایش یکدیگر، پیوند واندوالسی میسازند.
در بحت سطحشناسی، چسبندگی فیزیکی، زاویه تماس و در نتیجه آن ترشوندگی را تعیین میکند. هنگامیکه دو فاز (مانند جامد و مایع) با هم در تماس باشند، هرچه چسبندگی بین آن دو بیشتر باشد، زاویه تماس کمتر و ترشوندگی بیشتر خواهد بود. برعکس، هرچه همدوسی بیشتر باشد، ماده تمایل به تماس بیشتر با خود خواهد بود و از اینرو چسبندگی و ترشوندگی کمتر و زاویه تماس بیشتر میشود.
چسبندگی الکترواستاتیک
گاهی بین دو یا چند ماده با تبادل الکترون، نیروی الکترواستاتیک برقرار میشود و باعث تمایل مواد به قرارگیری کنار یکدیگر میشود.
نیروی همچسب و دگرچسب
نیروی همچسب(به انگلیسی: Cohesive Force) به برآیند نیروهای جاذبه از قبیل نیروهای واندروالسی و پیوند هیدروژنی که در سطح مولکولی بین ذرات همجنس یک ماده اثر میکنند گفته میشود. این نیرو که عامل پدیده پیوستگی است؛ مانع از همگسیختگی تودههای مایعات میشود. به عنوان مثال، تشکیل قطرات آب ناشی از وجود نیروی همچسب بین ذرات آن است.[1]
بهطور مشابه، نیروی دگرچسب(به انگلیسی: Adhesive Force) به برآیند نیروهای جاذبه، مانند نیروهای مکانیکی و نیروهای الکترواستاتیکی که در سطح مولکولی بین ذرات دو ماده غیر همجنس اثر میکنند، گفته میشود. این نیرو به عنوان عامل پدیده چسبندگی شناخته میشود.[1]
کشش سطحی
مقاله اصلی: کشش سطحی

به تمایل مایعات برای کمینه کردن سطح خارجی خود، کشش سطحی(به انگلیسی: Surface Tension) گفته میشود. این پدیده ناشی از اعمال نیروی همچسب بین ذرات مایع است. نیروی همچسب بین مولکولهای آب، باعث میشود سطح آن مانند یک پوسته در حال کشش رفتار کند. تشکیل حباب، کروی شدن قطرات مایع، شناور شدن حشرات روی آب و … نمونههایی از این اثر هستند.[2] عوامل متعددی از جمله جنس مایع و مواد محلول در آن، دما، فشار و … در این پدیده تأثیر گذار هستند.
ترشوندگی
پدیده ترشوندگی(به انگلیسی: Wetting)، در اثر برهمکنش بین ذرات یک مایع و یک سطح جامد رخ میدهد.[3]

نیروی دگرچسب بین ذرات شیشه و آب به اندازه است که مانع تشکیل قطرات کروی شکل میشود.

اگر نیروی دگرچسب بین ذرات مایع و ذرات سطح جامد به اندازه کافی بزرگ باشد؛ قطرات مایع، شکل کروی به خود نمیگیرند؛ بلکه به صورت تودههایی با اندازههای مختلف و ضخامت ناچیز، روی سطح جامد پخش میشوند. در این حالت گفته میشود مایع جامد را تر میکند. به این پدیده که در اثر غلبه نیروی دگرچسب بین ذرات مایع و سطح جامد، بر نیروی همچسب بین ذرات مایع و کشش سطحی مایع به وجود میآید؛ ترشوندگی یا ترشدن گفته میشود.[1][3]
آبگریزی
پدیده آبگریزی(به انگلیسی: Hydrophobicity)، عکس پدیده ترشوندگی است. همانند ترشوندگی، آبگریزی در اثر برهمکنش بین ذرات یک مایع و یک سطح جامد رخ میدهد.
اگر نیروی دگرچسب بین ذرات مایع و ذرات سطح جامد به اندازه کافی بزرگ نباشد، اثر پیوستگی به چسبندگی غلبه میکند. در این حالت مایع تمایل دارد تماس با سطح جامد را به حداقل برساند؛ بنابراین قطرات شکل کروی به خود میگیرند. عامل دیگر کروی شدن قطرات، پدیده کشش سطحی است.[1][3]
اثر مویینگی
مقاله اصلی: مویینگی
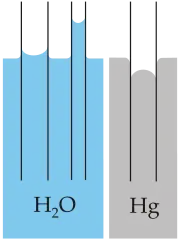
اثر مویینگی(به انگلیسی: Capillary Action)، به جاری شدن مایع در مجاری با قطر بسیار اندک، مانند لوله آزمایش، دستههای آوندی در گیاهان، مجاری بین الیاف کاغذ، و …، در اثر نیروهای دگرچسب و همچسب بین مایع و سطح داخلی مجرا گفته میشود. عوامل متعددی در رخ دادن این اثر دخیل هستند. از جمله آنها میتوان به جنس مایع و لوله، قطر لوله، جاذبه، دمای مایع و لوله، فشار هوای محیط و … اشاره کرد.
این اثر ممکن است به دو صورت رخ دهد. در نوع اول، که به آن مویینیگی جذبی (به انگلیسی: Capillary Attraction) گفته میشود؛ سطح مایع در لوله موئین، از سطح آزاد آن، بالاتر قرار میگیرد. اما در نوع دوم که مویینگی دفعی (به انگلیسی: Capillary Repulsion) نام دارد؛ عکس این حالت رخ میدهد؛ یعنی سطح مایع در لوله موئین، از سطح آزاد آن، پایینتر قرار میگیرد.[4]
توجیه اثر مویینگی با استفاده از مفهوم نیروی دگرچسب، همچسب و کشش سطحی امکانپذیر است. اگر نیروی دگرچسب بین مایع و سطح داخلی لوله موئین، از نیروی همچسب بین ذرات مایع بیشتر باشد، مایع تمایل دارد سطح تماس خود با لوله را بیشتر کند؛ به همین دلیل سطح مایع در لوله موئین، از سطح آزاد آن بالاتر قرار میگیرد و مویینگی جذبی رخ میدهد. همچنین به دلیل اینکه ذرات مایع تمایل دارند سطح تماس خود با لوله را بیشتر کنند، ذرات مایع که به دیوارههای لوله نزدیک هستند، بیشتر به سمت بالا حرکت میکنند؛ بنابراین مایع در لوله به شکل مقعر میایستد. اما اگر نیروی همچسب بین ذرات مایع از نیروی دگرچسب بین مایع و سطح داخلی لوله موئین بیشتر باشد، مایع تمایل دارد سطح تماس خود با لوله را کمتر کند؛ به همین دلیل سطح مایع در لوله موئین، از سطح آزاد آن پایینتر قرار میگیرد و مویینگی دفعی رخ میدهد. در این حالت ذرات مایع تمایل دارند تا حد امکان از دیوارههای لوله فاصله بگیرند. به این ترتیب مایع داخل لوله به شکل محدب میایستد.[4]
انحلال
انحلال(به انگلیسی: Dissolution) به فرایند تشکیل مخلوط همگن از دو ماده گفته میشود.نیروهای جاذبه و دافعه بین مولکولی، عامل تعیینکنندهای در انحلال پذیری مواد هستند. برای حل شدن ماده ای در مادهٔ دیگر، ذرات مواد حل شونده ابتدا باید از یکدیگر جدا شوند. اگر نیروی دگرچسب بین ذرات حلال و حل شونده از برآیند نیروی همچسب بین ذرات حلال و نیروی هم چسب بین ذرات حل شونده بیشتر باشد، انحلال صورت میگیرد. به این ترتیب پیوند بین ذرات حل شوند از بین میرود و این ذرات از یکدیگر جدا شده و بهطور یکنواخت در حلال پخش میشوند. عکس این حالت زمانی رخ میدهد که برآیند نیروی همچسب بین ذرات ماده اول و نیروی همچسب بین ذرات ماده دوم از نیروی دگرچسب بین ذرات ماده اول و ذرات ماده دوم بیشتر باشد. به این ترتیب ذرات مواد از یکدیگر جدا نمیشوند و دو فاز مختلف را تشکیل میدهند.[5]
چسبندگی سلولی
سلولها به کمک پیوندهای غیرکووالانسی بین درشتمولکولهای روی سطح سلول و درشتمولکولهای روی سطح سلول های دیگر، به یکدیگر میچسبند. چسبندگی سلولی(به انگلیسی: Cell Adhesion) برای رشد و نگهداری موجودات چندسلولی ضروری است. چسبندگی سلولی عامل ارتباط بین سلولی و شکلگیری ساختار های سلولی سه بعدی و اندامها است.[6]
جستارهای وابسته
| در ویکیانبار پروندههایی دربارهٔ چسبندگی موجود است. |
- نیروهای بین مولکولی
- پیوند هیدروژنی
- آبگریزی
- انحلال
- انحلال پذیری
- قانون هنری
- علم مواد
منابع
- John Comyn, Adhesion Science, Royal Society of Chemistry Paperbacks, 1997
- A.J. Kinloch, Adhesion and Adhesives: Science and Technology, Chapman and Hall, 1987
- Mortimer، Charles (۱۹۸۶). Chemistry. Wadsworth Publishing Company.
- «Cohesive and Adhesive Forces». libretexts. libretexts. دریافتشده در ۱۸ نوامبر ۲۰۲۰.
- «Surface Tension». libretexts. libretexts. دریافتشده در ۱۹ نوامبر ۲۰۲۰.
- «Wetting Agents». libretexts. libretexts. دریافتشده در ۱۸ نوامبر ۲۰۲۰.
- «Capillary Action». libretexts. libretexts. دریافتشده در ۱۸ نوامبر ۲۰۲۰.
- «Properties of Solutions». courses.lumenlearning.com. lumenlearning. دریافتشده در ۲۱ نوامبر ۲۰۲۰.
- Hoffman، Ronald (۲۰۱۸). Hematology: Basic Principles and Practice. Elsevier.