واکنش بارتون
واکنش بارتون(به انگلیسی: Barton reaction) یک نام واکنش در شیمی آلی است که طی آن یک نیتریت نورکافت شده و به δ-نیتروسو الکل تبدیل میشود. این واکنش به افتخار شیمیدان مشهور انگلیسی و برنده جایزه نوبل شیمی، درک بارتون نامگذاری شدهاست.[1]
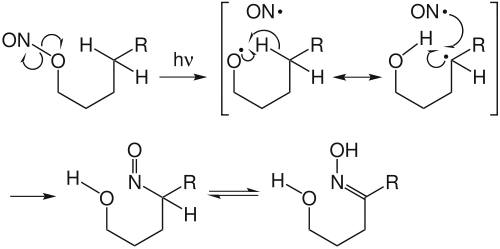
واکنش بارتون, شامل یک برش RO-NO است که شامل جدایش اتم هیدروژن, بازترکیب رادیکال آزاد , و واکنش تشکیل یک اکسیم است.[2] انتخاب پذیری برای δ-هیدروژن نتیجه ترکیب واسط رادیکالی ۶ عضوی است . اغلب، محل ترکیب اتم هیدروژن میتواند به راحتی پیشبینی شود. با توجه به توانایی منحصر به فرد برای مشتق کردن بسترهای بی طرف دیگر، بارتون از این واکنش به طور گسترده در دهه ۱۹۶۰ استفاده کرد تا تعدادی استروئید غیر طبیعی ایجاد کند .
مکانیزم واکنش و مکانگزینی
واکنش بارتون با شکست ناشی از پیوند نیتریت N-O با استفاده از لامپ جیوهای فشار بالا آغاز میشود .[3] این یک رادیکال آلکیلوکسلی تولید می کند که بلافاصله یک اتم هیدروژن را از δ - کربن جدا می کند. در صورت عدم وجود سایر منابع رادیکال یا سایر گروههای واکنشی پروگزیمال ، رادیکال آلکیل با رادیکال نیتروسیل نوترکیب می شود. ترکیبات حاصل از نیتروسو به محصول اکسیم منزوی تحت توتومر شدن قرار می گیرد.رادیکال محور کربن توسط سایر منابع رادیکال مانند ید یا آکریلونیتریل قابل رهگیری است. نمونه اول منجر به جایگزینی δ-هیدروژن با ید ، سپس چرخه متعاقب آن توسط یک واکنش SN2 منجر به یک تتراهیدروفوران می شود.[4] مثال دوم منجر به محصول کشش زنجیره ای با اکسیم تشکیل شده 2 واحد کربن بیشتر از اکسیژن از حالت عادی می شود.[5]
این فرضیه مکانیزمی توسط آزمایش اثر ایزوتوپ جنبشی پشتیبانی می شود.[6] برچسب زدن ایزوتوپی نیتریت با 15N مکانیسم غیر زاویه دار نشان داده است و رادیکال نیتروسیل شکل گرفته از یک نیتریت خاص به طور تصادفی با سایر رادیکال های آلکیل تشکیل شده است. با این حال ، نشان داده شده است که نوترکیب رادیکال نیتروسیل با رادیکال آلكوكسیل (واژگون شدن رخ همولیتیك) بدون تقارن برچسب ایزوتوپ ادامه می یابد.[7]این عدم وجود جفت شدن رادیکال بسته نیز با مشاهده اینکه رادیکالهای آلکیل تولید شده توسط شرایط بارتون می توانند تحت چرخش رادیکال قرار بگیرند، در حالی که واسطه های مشابه تولید شده توسط اکسیداسیون تتراستات سرب نیستند، پشتیبانی می شود.[8]
در موارد نادر ، به نظر می رسد كه رادیكال آلكوكسیل ممكن است قبل از انتزاع اتم هیدروژن از بین برود.[9]
در حالت متداول، از جمله در سیستم های استروئیدی، اتم هیدروژن از یک گروه متیل که دارای یک رابطه دیاکسایی 1،3 با رادیکال آلکوکسیل است، انتزاع می شود.[10] در صورت عدم وجود هیدروژن روی δ-کربن ، یا هنگامی که ترکیب خاصی از بستر باعث تشعشع ε-کربن در کنار هم شود، انتقال اتم هیدروژن 1،6 فرآیند مطلوب است. با این حال ، این واکنش ها بسیار کندتر از انتقال اتم هیدروژن 1،5 مربوطه هستند.
مطالعات محاسباتی نشان داده اند که اولویت برای انتقال اتم 1،5 هیدروژن بیش از انتقال اتم 1،6 هیدروژن به نظر می رسدو از آن که نتیجه یک حالت انتقال پایدار "صندلی مانند" باشد، بیشتر مورد علاقه آنتروپیکی قرار می گیرد.[11] در حقیقت ، محاسبه شده است که انتقال اتم 1،6 هیدروژن از یک گذار انجام می شود که در حدود 0.8 کیلو کالری در مول کمتر از مقدار اتم هیدروژن 1،5 است.
در سیستم های حلقوی، تجمع δ-هیدروژن هنوز هم مشاهده می شود، با این حال، تجمع آلفا-هیدروژن برای تشکیل کتون مربوطه رقابت می کند.[12]
در موارد خاص، بخصوص نیتریت های حاصل از الکل های سیکلوپنتیل، رادیکال های اکسیژن محور ترجیح می دهند از طریق جدا شدن پیوند C-C نسبت به تشکیل اتم H واکنش نشان دهند.[4] به عنوان مثال، هنگامی که شرایط بارتون ایجاد شد، نیکلیت سیکلوپنتیل مونوکسیم گلوتارآلدئید را تشکیل می دهد. این همچنین در مواردی مشاهده می شود که واسطه رادیکال ایجاد شده توسط تکه تکه شدن پایدار باشد ، مانند رادیکال آلیلیک که توسط قطعه ای از نیتریت ایزوپولگول شکل گرفته است.[13]
انواع مختلف
در سیستم های صلب مانند آلدوسترون، انتقال اتم 1،5 هیدروژن بسیار سریع است، با یک ثابت سرعت در اندازه ی 10 ^ 7 بر ثانیه انتقال اتمی H بین اتمی مشابه می تواند تا 100 برابر کندتر باشد.[14] علاوه بر این، انتقال اتم هیدروژن از تشکیل یک پیوند O-H قوی تر در مقابل پیوند ضعیف C-H استفاده می کند. برای تشکیل یک رادیکال آلکیل اولیه ، دوم یا سوم از یک رادیکال آلكوكسیل، نیروی محرك به ترتیب 3 كیلوكالری در مول، 5 كیلوكالری در مول و 9 كیلوکالری در مول وجود دارد.[10] رادیکال آلکیل تشکیل شده پس از انتقال اتم هیدروژن مستعدایجاد واکنشهای رادیکال استاندارد است، وقتی که اسکنرها در مقدار کافی برای حاصل شدن از رادیکال نیتروسیل وجود دارند. بلافاصله پس از افشای اولیه آزمایش، بارتون و همکارانش از به دام انداختن رادیکال با I2 و CCl3Br (به ترتیب به عنوان منابع رادیکال ید و برم) برای تشکیل δ-هالو-الکل خبر دادند. این گونه هالوهیدرین را می توان تحت شرایط اولیه به مشتقات تتراهیدروپیران مربوطه تبدیل کرد.[15]
مقادیر زیادی از آلکن های فعال شده می توانند برای رهگیری رادیکال آلکیل مورد استفاده قرار گیرند و منجر به تشکیل پیوند C-C از پیوند C-H غیرفعال شوند.[16]
در حضور اکسیژن، رادیکال آلکیل به دام می افتد و یک رادیکال پراکسید آلی را تشکیل می دهد. این واسطه را رادیکال نیتروسیل به دام می اندازد و سپس برای دادن یک استر δ-نیترات که همزمان هم اسید و هم پایه ای با ثبات است، ایزومر شده و در شرایط خفیف می تواند به الکل مربوطه کاهش یابد.[17]
کاربردها در سنتز مولکول پیچیده
آلدوسترون استات
در نشریاتی که بلافاصله پس از افشای اولیه بارتون از این واکنش در ژورنال انجمن شیمی آمریکا منتشر شده است، ترکیب سنتز آلدوسترون استات نشان داده شده است.[18] اجازه دادن به کورتیکواسترون استات در واکنش با نیتروسیل کلرید در پیریدین خشک نیتریت را حاصل می کند.بعد از تابش در جو بی اثر و پس از آن با نگهداری در نیتریت سدیم آبی اکسیم مورد نظر را تشکیل می دهد. سپس اکسیم استیله شده و هیدرولیز می شود تا محصول طبیعی همی استال حاصل شود.
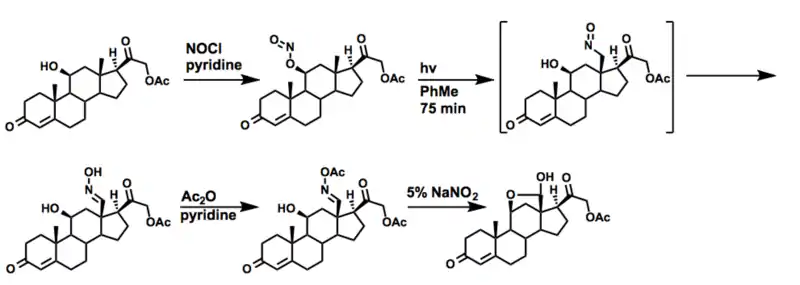
آزادیرادیون
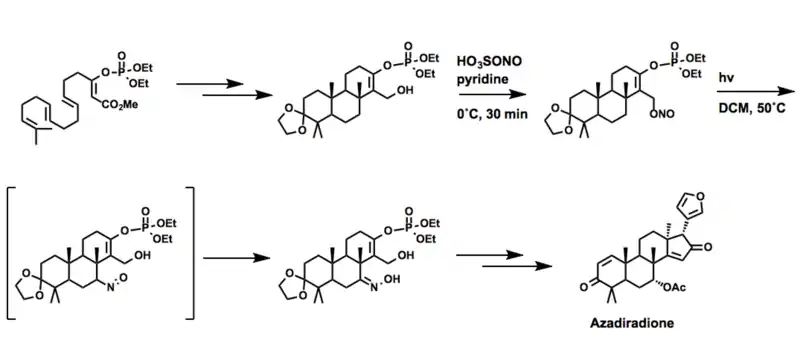
کوری نیز واکنش بارتون را در سنتز آزادیرادیون، به عنوان عضوی از خانواده لیمونوئید محصولات طبیعی به کار برد. در این حالت از اسید نیتروسیل سولفوریک به جای نیتروسیل کلرید استفاده می شود.[19]
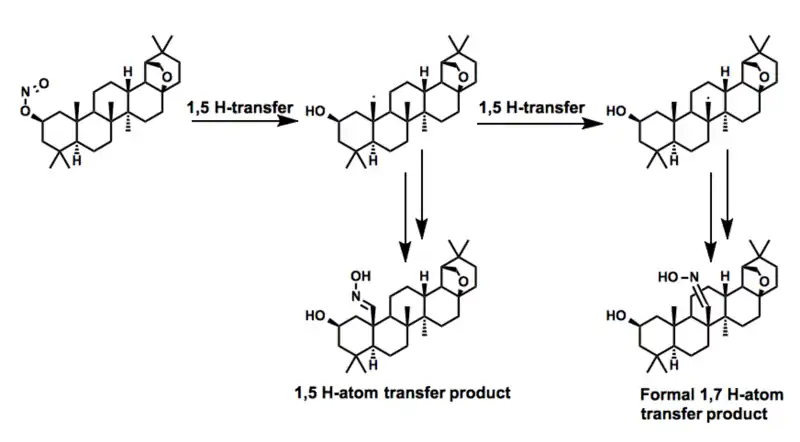
مشتقات آلوباتولین
در فرآیند آماده سازی یک سری مشتقات آلوبتولین تری پپیروئید، دیهان و همکارانش یک تحول قابل توجه حاصل از دو انتقال اتم هیدروژن 1،5 متوالی را مشاهده کردند. در حالی که محصول انتقال اتمی تک هیدروژن 1،5 نیز مشاهده شد، تحول قبلی نشان دهنده یک انتقال اتم هیدروژن 1،7 در مسافت بسیار زیاد است.[20]
منابع
- Barton, D. H. R.; Beaton, J. M.; Geller, L. E.; Pechet, M. M. (1961). "A New Photochemical Reaction1". Journal of the American Chemical Society. 83 (19): 4076–4083. doi:10.1021/ja01480a030. ISSN 0002-7863.
- «IUPAC - Barton reaction (B00599)». goldbook.iupac.org. doi:10.1351/goldbook.b00599. دریافتشده در ۲۰۱۹-۱۱-۰۶.
- Sugimoto, Atsushi; Fukuyama, Takahide; Sumino, Yukihito; Takagi, Makoto; Ryu, Ilhyong (2009-02-21). "Microflow photo-radical reaction using a compact light source: application to the Barton reaction leading to a key intermediate for myriceric acid A". Tetrahedron. 65 (8): 1593–1598. doi:10.1016/j.tet.2008.12.063. ISSN 0040-4020.
- Akhtar, M.; Barton, D. H. R.; Sammes, P. G. (1965-10-01). "Some Radical Exchange Reactions during Nitrite Ester Photolysis1". Journal of the American Chemical Society. 87 (20): 4601–4607. doi:10.1021/ja00948a036. ISSN 0002-7863.
- Petrović, Goran; Čeković, Živorad (1997-01-27). "Free radical alkylation of the remote nonactivated δ-carbon atom". Tetrahedron Letters. 38 (4): 627–630. doi:10.1016/S0040-4039(96)02357-X. ISSN 0040-4039.
- Barton, Derek H. R.; Hesse, Robert H.; Pechet, Maurice M.; Smith, Leslie C. (1979-01-01). "The mechanism of the barton reaction". Journal of the Chemical Society, Perkin Transactions 1 (0): 1159–1165. doi:10.1039/P19790001159. ISSN 1364-5463.
- Akhtar, M.; Pechet, M. M. (1964-01-01). "The Mechanism of the Barton Reaction". Journal of the American Chemical Society. 86 (2): 265–268. doi:10.1021/ja01056a035. ISSN 0002-7863.
- Čeković, Ẑivorad; Ilijev, Dimitar (1988-01-01). "Intramolecular cyclization of alkenyl radicals generated by 1,5-hydrogen transfer to alkoxy radicals". Tetrahedron Letters. 29 (12): 1441–1444. doi:10.1016/S0040-4039(00)80319-6. ISSN 0040-4039.
- Nickson, A; Mahajan, J; McGuire, F (1961-09-01). "Communications- Epimerization in a Nitrite Ester Photolysis". The Journal of Organic Chemistry. 26 (9): 3617–3618. doi:10.1021/jo01067a671. ISSN 0022-3263.
- Čeković, Živorad (2003-10-06). "Reactions of δ-carbon radicals generated by 1,5-hydrogen transfer to alkoxyl radicals". Tetrahedron. 59 (41): 8073–8090. doi:10.1016/S0040-4020(03)01202-X. ISSN 0040-4020.
- Dorigo, Andrea E.; McCarrick, Margaret A.; Loncharich, Richard J.; Houk, K. N. (1990-10-01). "Transition structures for hydrogen atom transfers to oxygen. Comparisons of intermolecular and intramolecular processes, and open- and closed-shell systems". Journal of the American Chemical Society. 112 (21): 7508–7514. doi:10.1021/ja00177a009. ISSN 0002-7863.
- Ishmuratov, G. Yu.; Kharisov, R. Ya.; Shayakhmetova, A. Kh.; Botsman, L. P.; Shitikova, O. V.; Tolstikov, G. A. (2005-11-01). "Ozonolysis of Ricinolic Acid Derivatives and Transformations of the Ozonolysis Products under Barton Reaction Conditions". Chemistry of Natural Compounds. 41 (6): 643–649. doi:10.1007/s10600-006-0003-z. ISSN 1573-8388.
- Bulliard, Michel; Balme, Geneviève; Gore, Jacques (1989-01-01). "Fragmentation of isopulegol by a radical process". Tetrahedron Letters. 30 (17): 2213–2216. doi:10.1016/S0040-4039(00)99651-5. ISSN 0040-4039.
- Robertson, Jeremy; Pillai, Jayasheela; Lush, Rachel K. (2001-01-01). "Radical translocation reactions in synthesis". Chemical Society Reviews. 30 (2): 94–103. doi:10.1039/B000705F. ISSN 1460-4744.
- Akhtar, M.; Barton, D. H. R.; Sammes, P. G. (1964-08-01). "Radical Exchange during Nitrite Photolysis". Journal of the American Chemical Society. 86 (16): 3394–3395. doi:10.1021/ja01070a039. ISSN 0002-7863.
- Petrović, Goran; Čeković, Živorad (1999-01-29). "Alkylation of remote non-activated δ-carbon atoms: Addition of δ-carbon radicals, generated by 1,5-hydrogen transfer in alkoxy radical intermediates, to activated olefins". Tetrahedron. 55 (5): 1377–1390. doi:10.1016/S0040-4020(98)01110-7. ISSN 0040-4020.
- Allen, John; Boar, Robin B.; McGhie, James F.; Barton, Derek H. R. (1973-01-01). "Nitrite photolysis in the presence of oxygen. An improved synthesis of 32-oxygenated lanostanes". Journal of the Chemical Society, Perkin Transactions 1 (0): 2402–2404. doi:10.1039/P19730002402. ISSN 1364-5463.
- Barton, D. H. R.; Beaton, J. M. (1960-05-01). "A SYNTHESIS OF ALDOSTERONE ACETATE". Journal of the American Chemical Society. 82 (10): 2641–2641. doi:10.1021/ja01495a062. ISSN 0002-7863.
- Corey, E. J.; Hahl, Robert W. (1989-01-01). "Synthesis of a limonoid, azadiradione". Tetrahedron Letters. 30 (23): 3023–3026. doi:10.1016/S0040-4039(00)99392-4. ISSN 0040-4039.
- Dehaen, Wim; Mashentseva, Anastassiya A.; Seitembetov, Talgat S. (2011/3). "Allobetulin and Its Derivatives: Synthesis and Biological Activity". Molecules. 16 (3): 2443–2466. doi:10.3390/molecules16032443. PMC 6259842. PMID 21403601. Check date values in:
|date=(help)
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3.
