میوگلوبین
میوگلوبین نوعی هموگلوبین است که در رشتههای ماهیچهای یافت میشود. میوگلوبین فقط یک رشته پلیپپتیدی حاوی یک «هم» دارد که میتواند به یک مولکول اکسیژن متصل شود.
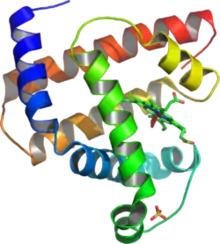
میوگلوبین یک پروتئین تکرشتهای است که از ۱۵۳ آمینو اسید و یک هم تشکیل شدهاست که گروه هم در وسط ۸ مارپیچ آلفا قرار دارد که در برخی نقاط دارای خمیدگی میباشد و این پروتئین در ذخیره و انتقال اکسیژن در ماهیچههای انسان نقش دارد. این مارپیچ را از انتهای N یا آمینی (N terminal) نامگذاری کرده و از A تا H نامگذاری میشودکه H آخرین مارپیج است که در انتهای C یا کربوکسیل (C terminal) قرار دارد. در ناحیههای خمیدگی ریشه اسید آمینه پرولین وجود دارند و عامل خمش در میوگلوبین میباشند. در وسط گروه هم یک مولکول آهن موجود است که در وضعیت فرو مستقر شده که این آهن دارای دو پیوند کوئوردینانسی میباشد. اتصال اکسیژن به گروه هم باعث تغییر خصوصیات الکترونیکی آن میشود که همین مسئله باعث تغییر رنگ خون بنفش تیره (فاقد اکسیژن) در سیاهرگها به رنگ قرمز روشن (مملو از اکسیژن) در سرخرگها شود.[1] در بدن فرد بالغ و سالم در حدود ۴ گرم آهن وجود دارد که در هموگلوبین گلبولهای قرمز و نیز در میوگلوبین ماهیچه هاست. میوگلوبین هم مانند هموگلوبین شامل منیزیم است.
میل ترکیبی میوگلوبین به اکسیژن بیشتر از هموگلوبین است. در فشاری از اکسیژن که هموگلوبین، اکسیژن خودش را آزاد میکند، میوگلوبین هنوز به اکسیژن متصل است و هنگامی که فشار اکسیژن بافت کم باشد، و هموگلوبین نتواند اکسیژن بیشتری آزاد کند، میوگلوبین اکسیژن خودش را آزاد میکند. علاوه بر پرندگان، پستاندارانی که در آب غواصی میکنند (مانند سیلها)، نیز میوگلوبین فراوانی در ماهیچههای خود دارند تابتوانند مدت بیشتری در آب بمانند.
پانویس
- Martin D. Vesper, Bert L. de Groot, Dennis R. Livesay: Collective Dynamics Underlying Allosteric Transitions in Hemoglobin. In: PLoS Computational Biology, Band 9, 2013, S. e1003232, doi:10.1371/journal.pcbi.1003232.
- حمید بهایندری
