ساختار لوویس
ساختار لوویس (به انگلیسی: Lewis structure) یا ساختار الکترون نقطه[1] (به انگلیسی: electron dot structure) یا ساختار پیوند ظرفیتی[2] (به انگلیسی: Valence-bond structure) ساختاری برای نمایش مولکول یا یون در شیمی است که در آن عناصر را با نماد شیمیایی، الکترونهای ظرفیتی ناپیوندی را با نقطه و پیوندها را با خط نمایش میدهند.[1][2] در این ساختار بار قراردادی نیز نمایش داده میشود.[1] این فرمول را به پاس گیلبرت نیوتون لوویس، دانشمند آمریکایی که در سال ۱۹۱۶ نظریه پیوند کووالانسی را ارائه داد، لوویس نامیدند.[2]
مراحل رسم ساختار لوویس
برای رسم انواع ساختار لوویس از الگوریتم داده شده استفاده میکنیم.[3] مراحل باید به ترتیب طی شوند.
۱. تعیین اتم مرکزی:
در ساختار لوویس اتمی را که ۳ شرط زیر را داشته باشد اتم مرکزی مینامیم و دیگر اتمها را اتم اطراف مینامیم.
- اتمی که کمترین تعداد را داشته باشد واگر تعدادها برابر بود:
- اتمی که در لایه ظرفیت خود اوربیتال تک الکترونی بیشتری داشته باشد و اگر تعداد آنها نیز برابر بود:
- اتمی که الکترونگاتیوی آن از بقیه اتمها کمتر باشد.
- در ساختار لوویس، هر مولکول یا یون هر اتمی که اتم مرکزی نباشد، اتم اطراف نام میگیرد.
برای نمونه، در تترا کلرو متان یا کربن تترا کلرید (CCl۴) اتم مرکزی C و اتمهای اطراف Clها هستند.
در مورد ۱ استثناً در مولکول N۲O یکی از نیتروژنها اتم مرکزی است.
- هیدروژن هیچگاه اتم مرکزی نخواهد بود
مثال:
| دلیل | اتم مرکزی | مولکول یا یون |
|---|---|---|
| تعداد | C | CCl۴ |
| اوربیتال تک الکترونی بیشتر با وجود تعداد برابر | N | N۲F۲ |
| الکترونگاتیوی کمتر با وجود برابری تعداد و تعداد اوربیتال تک الکترونی مساوی(S,O) | S | S۲O۲Cl۲ |
۲. دانستن آرایش الکترونی لایه ظرفیت (والانس) اتم مرکزی و محاسبه تعداد اوربیتال نیمه پر آن:
| گروه ۱ | گروه 2(Be) | گروه ۱۳ | گروه ۱۴ | گروه ۱۵ | گروه ۱۶ | گروه ۱۷ | گروه ۱۸ |
|---|---|---|---|---|---|---|---|
| یونی | ns2 np0 | ns2 np1 | ns2 np2 | ns2 np3 | ns2 np4 | ns2 np5 | ns2 np6 |
- مثال: N(نیتروژن) در گروه ۱۵ جای دارد و به آرایش الکترونی ns2 np3 ختم میشود پس ۳ اوربیتال نیمه پر دارد.
۳. تعیین اینکه آیا اتم مرکزی میتواند برانگیخته شود یا خیر؟
- مفهوم بر انگیختگی در رسم ساختار لوویس یعنی توانایی تبدیل اوربیتال پر به نیمه پر با جابه جایی الکترون در هر لایه.
- مثال: تبدیل ns2 np2 به ns1 np3 یا تبدیل ns2 np3 به ns1 np3 (n-1)d1
- مفهوم بر انگیختگی در رسم ساختار لوویس یعنی توانایی تبدیل اوربیتال پر به نیمه پر با جابه جایی الکترون در هر لایه.
- در میان عناصر فقط عنصرهای F,O،N,Cl نمیتوانند برانگیخته شوند.
- کربن در همه حال برانگیخته است(ns1 np3) مگر در مولکول مونوکسید کربن CO و یون سیانید -CN که ns2 np2 است
۴. آیا اتم مرکزی نیازی به برانگیخته شدن دارد یا خیر؟
- در حالت کلی عنصر موقعی برانگیخته میشود که نیاز به اوربیتال نیمه پر اضافه تر باشد برای مثال در ساختار PCl3 نیازی به برانگیخته شدن نیست چون به تعداد کافی اوربیتال نیمه پر برای اتمهای اطراف وجود داردولی در مورد PCl5 اوربیتال نیمه پر برای اتمهای اطراف کافی نیست نیاز به برانگیخته شدن وجود دارد.
- ساختار P در ns2 np3 = PCl3
- ساختار P در ns1 np3 (n-1)d1 = PCl5
در مورد POCl3 باید گفت که در آن عملاً اوربیتال نیمه پر برای O وجود ندارد ولی P برای ایجاد پیوند با اکسیژن هیچگاه برانگیخته نخواهد شد. علت آن را در ادامه جویا میشویم.
- معمولاً عناصر به غیر از (Si , Be) برای پیوند با O برانگیخته نمیشوند زیرا اکسیژن تمایل زیادی به تشکیل پیوند داتیو دارد.
۵.
- اگر یون مورد نظر دارای بار منفی بود، آن بار به اتم الکترونگاتیوتر میرسد. (به غیر از یون سیانید -CN که بار منفی استثناً به C میرسد)
- اگر یون مورد نظر دارای بار مثبت بود، آن بار به اتم الکتروپازتیوتر میرسد. (به غیر از یون متیلیم +CH3 که بار مثبت استثناً به C میرسد)
۶. رفتارشناسی عناصر
| شماره گروه | دارای بار مثبت | دارای بار منفی | مثال |
|---|---|---|---|
| ۱۴ | رفتاری شبیه به گروه۱۳ | رفتاری شبیه به گروه15 | +C شبیه B و -C شبیه N |
| ۱۵ | رفتاری شبیه به گروه۱۴ | رفتاری شبیه به گروه16 | +N شبیه C و -N شبیه O |
| ۱۶ | رفتاری شبیه به گروه۱۵ | رفتاری شبیه به گروه17 | +Se شبیه As و -O شبیه F |
| ۱۷ | رفتاری شبیه به گروه۱۶ | رفتاری شبیه به گروه18 | +I شبیه O و -F شبیه Xe |
| ۱۸ | ---- | ---- | ---- |
۷. نکاتی برای رسم:
- اکسیژن در صورت وجود ۲ اوربیتال نیمه پر پیوند دوگانه تشکیل می دهدو در صورت عدم وجود آن پیوند داتیو تشکیل میدهد.
- هالوژنها وهیدروژن و -O فقط پیوند یگانه تشکیل میدهند.
- اگر در ساختاری هم O وجود داشت هم هالوژن (مثل COCl2)، اولویت پیوند یگانه هالوژن هاست.
- -H و -F و -Cl همیشه داتیو میدهند.
- +H همیشه داتیو میپذیرد.
- اگر در ساختاری هم O وجود داشت هم -O، اولویت با پیوند یگانه -O است.
۸. در رسم اکسی اسیدها:
- ابتدا ساختار بنیان اسید را رسم میکنیم.
- سپس از طریق -Oها با اتمهای هیدروژن پیوند یگانه تشکیل میدهیم.
چند نمونه ساختار رسم شده
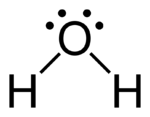
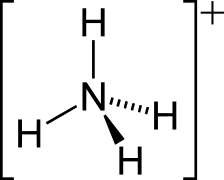 آمونیوم
آمونیوم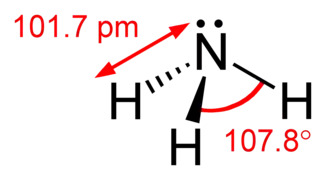 آمونیاک
آمونیاک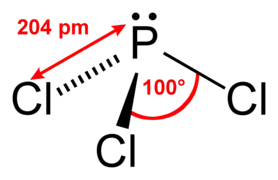 فسفر تری کلرید
فسفر تری کلرید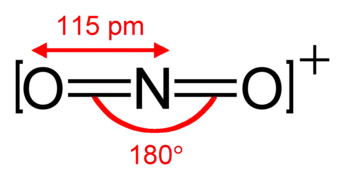 یون نیترونیوم
یون نیترونیوم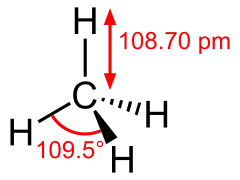 متان
متان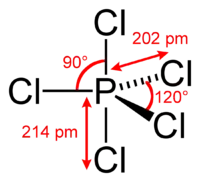 فسفر پنتاکلرید
فسفر پنتاکلرید
جستارهای وابسته
منابع
- IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.
- مورتیمر، چارلز (۱۳۸۸)، «پیوند کوالانسی»، شیمی عمومی، ترجمهٔ عیسی یاوری (ویراست ویرایش ششم (۱۹۸۶))، تهران: نشر علوم دانشگاهی، ص. ص ۱۰۷، شابک ۹۶۴-۶۱۸۶-۳۳-۵
- آموزش شیمی عمومی (سید احسان هادی)
