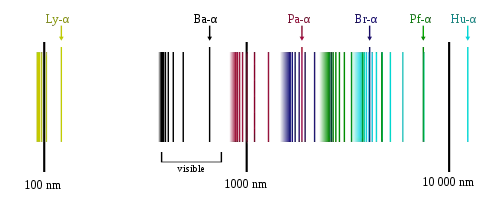
خطوط طیفی هیدروژن
در طیف تابشی اتم هیدروژن چند سری وجود دارد که بر اساس فرمول ریدبرگ بدست میآید. سریهای طیفی در اخترشناسی برای بررسی حضور هیدروژن و محاسبه انتقال قرمز کاربرد دارند.
فیزیک
در فیزیک انتشار این امواج به این دلیل است که الکترونها در مدارهای مانا در اطراف هسته هیدروژن میگردند و هنگامی که از مدار مانا با انرژی بیشتر به مدار با انرژی کمتر بروند. انرژی مازاد را که فاصله بین این دو مدار است تابش میکنند.
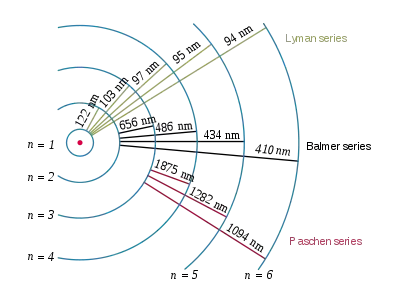
نامگذاری هر انتقال به صورت بیان نام سری و سپس حروف الفبای یونانی است به این ترتیب که از نزدیکترین مدار اگر به مدار موردنظر رفت آلفا سپس بتا و دیگر حروف یونانی. مثلاً انتقال از ۲ → ۱ «لیمان-آلفا» (Ly-α) نامیده میشود و ۷ → ۳ «پاشن-دلتا» (Pa-δ).
فرمول ریدبرگ
میزان انرژی جذبشده یا تابششده میان الکترونی که در مدار مانا جابجا شود از فرمول ریدبرگ بدست میآید:[1]
که n مدار اولیه است، n′ مدار نهایی است، و R ثابت ریدبرگ.[2]
سریها
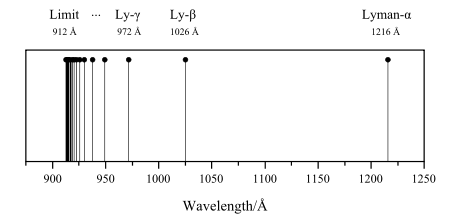
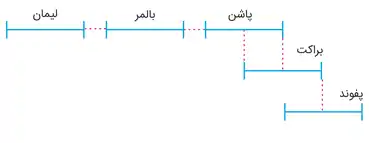
لیمان (n′ = ۱)
| λ (nm) | |
|---|---|
| ۲ | ۱۲۲ |
| ۳ | ۱۰۳ |
| ۴ | ۹۷٫۲ |
| ۵ | ۹۴٫۹ |
| ۶ | ۹۳٫۷ |
| ۹۱٫۱ |
به نام کاشف آن تئودور لیمان نامگذاری شدهاست و در محدوده فرابنفش قرار دارد.
سری بالمر (n'= ۲)
| λ (nm) | |
|---|---|
| ۳ | ۶۵۶ |
| ۴ | ۴۸۶ |
| ۵ | ۴۳۴ |
| ۶ | ۴۱۰ |
| ۷ | ۳۹۷ |
| ۳۶۵ | |
به افتخار یوهان بالمر نامگذاری شده و دوتای این خطوط در محدوده فرابنفش و بقیه آن در محدوده نور مرئی قرار میگیرد. خطوط مرئی آن در خطوط فرانهوفر نیز وجود دارند

سری پاشن (n′ = ۳)
| λ (nm) | |
|---|---|
| ۴ | ۱۸۷۰ |
| ۵ | ۱۲۸۰ |
| ۶ | ۱۰۹۰ |
| ۷ | ۱۰۰۰ |
| ۸ | ۹۵۴ |
| ۸۲۰ |
به نام فردریش پاشن هستند و در محدوده فروسرخ قرار میگیرند.[3]
براکت (n′ = ۴)
| λ (nm) | |
|---|---|
| ۵ | ۴۰۵۰ |
| ۶ | ۲۶۳۰ |
| ۷ | ۲۱۷۰ |
| ۸ | ۱۹۴۰ |
| ۹ | ۱۸۲۰ |
| ۱۴۶۰ |
به نام فردریک براکت دانشمند آمریکایی که اولین بار در سال ۱۹۲۲ این خطوط را مشاهده کرد.[4]
سری پفوند (n′ = ۵)
| λ (nm) | |
|---|---|
| ۶ | ۷۴۶۰ |
| ۷ | ۴۶۵۰ |
| ۸ | ۳۷۴۰ |
| ۹ | ۳۳۰۰ |
| ۱۰ | ۳۰۴۰ |
| ۲۲۸۰ |
در سال ۱۹۲۴ توسط آگست هرمان فوند برای نخستین بار مشاهده شد.[5]
سری همفریس (n′ = ۶)
| λ (nm) | |
|---|---|
| ۷ | ۱۲۴۰۰ |
| ۸ | ۷۵۰۰ |
| ۹ | ۵۹۱۰ |
| ۱۰ | ۵۱۳۰ |
| ۱۱ | ۴۶۷۰ |
| ۳۲۸۰ |
توسط فیزیکدانان آمریکایی کورتیس همفریس کشف شد.[6]
گسترۀ طول موج های هر رشته به صورت شماتیک
جستارهای وابسته
- اختر طیفسنجی
- قانون موزلی
منابع
- Bohr, Niels (1985), "Rydberg's discovery of the spectral laws", in Kalckar, J., N. Bohr: Collected Works, 10, Amsterdam: North-Holland Publ., pp. 373–9
- "CODATA Recommended Values of the Fundamental Physical Constants: 2006" (PDF). Committee on Data for Science and Technology (CODATA). مؤسسه ملی فناوری و استانداردها.
- Paschen, Friedrich (1908), "Zur Kenntnis ultraroter Linienspektra. I. (Normalwellenlängen bis 27000 Å. -E.)", Annalen der Physik, 332 (13): 537–570, Bibcode:1908AnP...332..537P, doi:10.1002/andp.19083321303, archived from the original on 17 December 2012, retrieved 1 July 2011
- Brackett, Frederick Sumner (1922), "Visible and infra-red radiation of hydrogen", Astrophysical Journal, 56: 154, Bibcode:1922ApJ....56..154B, doi:10.1086/142697
- Pfund, A. H. (1924), "The emission of nitrogen and hydrogen in infrared", J. Opt. Soc. Am., 9 (3): 193–196, doi:10.1364/JOSA.9.000193
- Humphreys, C.J. (1953), "Humphreys Series", J. Research Natl. Bur. Standards, 50