باتری لیتیم-هوا
باتری لیتیم-هوا(به انگلیسی: Lithium–air battery) (مخفف انگلیسی: Li-air) گونهای از باتریهای نوع دوم هستند که در آن از فلز لیتیم در آند و اکسیژن هوا در کاتد استفاده میشود. این باتریها میتوانند ولتاژ اسمی تا ۲٫۹۱ ولت ایجاد کنند. باتری لیتیوم-هوا (Li-air) یک سلول الکتروشیمیایی یا [باتری فلز-هوا] است که از اکسیداسیون لیتیوم در آند و کاهش اکسیژن در کاتد برای القای جریان جریان استفاده می کند. جفت شدن لیتیوم و اکسیژن محیط از نظر تئوری می تواند منجر به سلولهای الکتروشیمیایی با بالاترین انرژی ممکن شود. در واقع، انرژی خاص نظری یک باتری غیر آبی Li-air، در حالت شارژ شده با محصول Li2O2 و به استثنای توده اکسیژن، ~40.1 MJ/kg است. این قابل مقایسه با انرژی خاص نظری بنزین ، ~46.8 MJ/kg است. در عمل، باتری های Li-air با انرژی خاص ~6.12 MJ/kg در سطح سلول نشان داده شده است. این مقدار تقریباً 5 برابر بیشتر از باتری یونلیتیم تجاری است و برای کار با یک وسیله نقلیه الکتریکی 2000 کیلوگرمی برای 500 کیلومتر (310 مایل) با یک بار شارژ با استفاده از 60 کیلوگرم باتری کافی است. با این حال، قدرت عملیاتی و چرخه عمر باتری های Li-air قبل از یافتن جایگاه بازار به پیشرفت های چشمگیری نیاز دارد. پیشرفت های قابل توجه الکترولیت برای توسعه یک اجرای تجاری مورد نیاز است. چهار رویکرد در نظر گرفته شده است: آلی ، آبی ، حالت جامد و مخلوط آبی - آلی. عامل اصلی بازار باتری ها، بخش خودرو است. چگالی انرژی بنزین تقریباً 13 کیلووات ساعت بر کیلوگرم است که مربوط به 1.7 کیلووات ساعت بر کیلوگرم انرژی است که پس از تلف شدن به چرخ ها می رسد. از نظر تئوری، لیتیوم هوا می تواند 12 کیلووات ساعت در کیلوگرم (43.2 MJ/kg) را به استثنای توده اکسیژن بدست آورد. با توجه به وزن بسته کامل باتری (پوشش، کانال های هوا، بستر لیتیوم)، در حالی که لیتیوم به تنهایی بسیار سبک است، چگالی انرژی به طور قابل توجهی پایین تر است.
تاریخچه
باتری های Li-air که در اصل در دهه 1970 به عنوان منبع احتمالی برق برای وسایل نقلیه الکتریکی باتری و وسایل نقلیه الکتریکی هیبریدی پیشنهاد می شد، در اواخر دهه اول 2000 به دلیل پیشرفت در علم مواد، مورد توجه علمی قرار گرفتند.
اگرچه ایده وجود یک باتری لیتیوم - هوا مدتها قبل از سال 1996 بود، نسبت خطر به سود برای پیگیری بسیار بالا تصور می شد. در واقع، هر دو الکترود منفی (فلز لیتیوم) و مثبت (هوا یا اکسیژن) دلیل این امر هستند که به ترتیب، باتری های لیتیوم فلزی قابل شارژ در دهه 1970 به بازار نرسیدند (باتری یونلیتیم در یک دستگاه تلفن همراه از ترکیب گرافیت LiC6- روی الکترود منفی، نه یک فلز لیتیوم). با این وجود، به دلیل کمبود قابل درک سایر گزینه ها برای باتری های قابل شارژ با انرژی زیاد و به دلیل برخی نتایج امیدوار کننده از آزمایشگاه های دانشگاهی ، هم تعداد حق ثبت اختراع و هم انتشارات حوزه آزاد مربوط به اکسیژن لیتیوم (از جمله Li-air) باتری ها در سال 2006 رشد نمایی کردند. با این حال، مشکلات فنی پیش روی چنین باتری ها، به ویژه زمان شارژ مجدد، حساسیت به نیتروژن و آب و هدایت ضعیف ذاتی گونه های شارژ شده Li2O2 چالش های اساسی است.
طراحی و بهره برداری
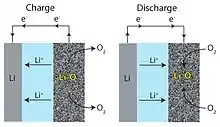
به طور کلی یون های لیتیوم بین آند و کاتد در سراسر الکترولیت حرکت می کنند. در حال تخلیه، الکترون ها مدار خارجی را برای انجام کارهای الکتریکی دنبال می کنند و یون های لیتیوم به کاتد مهاجرت می کنند. در هنگام شارژ صفحات فلزی لیتیوم بر روی آند ، آزاد شدن O2 در کاتد. باتری های غیرآبی (با Li2O2 یا LiO2 به عنوان فرآورده های تخلیه) و آبی (LiOH به عنوان محصول تخلیه) باتری Li-O2 در نظر گرفته شده است. باتری آبی برای جلوگیری از واکنش فلز Li با آب به یک لایه محافظ روی الکترود منفی نیاز دارد.
آند فلز لیتیوم یک انتخاب معمول آند است. در آند، پتانسیل الکتروشیمیایی فلز لیتیوم را وادار می کند تا از طریق اکسیداسیون (بدون درگیر شدن اکسیژن کاتدیک) الکترونها را آزاد کند. نیمه واکنش این است: Li ⇌ Li+ + e−
لیتیوم دارای ظرفیت ویژه بالا (3840 میلی آمپر ساعت در گرم) در مقایسه با سایر مواد باتری فلزی - هوا (820 میلی آمپر ساعت در گرم برای روی ، 2965 میلی آمپر ساعت در گرم برای آلومینیوم) است. چندین مسئله بر چنین سلولهایی تأثیر می گذارد. چالش اصلی در توسعه آند جلوگیری از واکنش آند با الکترولیت است. گزینه های جایگزین شامل مواد جدید الکترولیت یا طراحی مجدد رابط بین الکترولیت و آند هستند. آندهای لیتیوم با کاهش رسوبات لیتیوم دندریتیک، باعث کاهش ظرفیت انرژی یا ایجاد اتصال کوتاه می شوند. اثرات اندازه منافذ و توزیع اندازه منافذ به خوبی درک نشده است.
با شارژ / تخلیه در سلولهای آپروتیک، لایه های نمکهای لیتیوم بر روی آند رسوب می کنند و در نهایت آن را می پوشانند و مانعی بین لیتیوم و الکترولیت ایجاد می کنند. این سد در ابتدا از خوردگی جلوگیری می کند ، اما در نهایت از سینتیک واکنش بین آند و الکترولیت جلوگیری می کند. این تغییر شیمیایی رابط جامد - الکترولیت (SEI) منجر به تغییر ترکیب شیمیایی در سطح می شود و باعث می شود جریان به همین ترتیب تغییر کند. توزیع جریان ناهموار باعث انشعاب رشد دندریت (شاخه های متعدد) می شود و معمولاً منجر به اتصال کوتاه بین آند و کاتد می شود.
در سلولهای آبی مشکلات SEI از واکنش بالای فلز لیتیوم با آب ناشی می شود.
چندین روش برای غلبه بر این مشکلات می باشد:
تشکیل یک لایه محافظ یون لیتیوم با استفاده از الکترولیت های کوپلیمر دی و ترایبلاک. به گفته شرکت Seeo ، این الکترولیتها (به عنوان مثال، پلی استایرن با هدایت بالای یون لیتیوم در یک بخش پلیمر نرم، مانند پلی (اکسید اتیلن (PEO) و مخلوط نمک Li) ثبات مکانیکی را ترکیب می کنند. سختی از طریق انسداد مکانیکی دندریت را مهار می کند.
مواد شیشه ای یا سرامیک شیشه ای هدایت کننده لیتیوم یونی (به طور کلی) به راحتی توسط فلز لیتیوم کاهش می یابند، و بنابراین یک فیلم نازک از یک ماده رسانا لیتیوم پایدار ، مانند Li3Pdیا Li3N ، می تواند بین سرامیک و فلز قرار داده شود. این SEI مبتنی بر سرامیک مانع از تشکیل دندریت ها شده و از فلز لیتیوم در برابر آلودگی جوی محافظت می کند.
کاتد در هنگام شارژ در کاتد، اکسیژن از طریق کاهش الکترون را به لیتیوم اهدا می کند. از کربن مزوپور به عنوان یک بستر کاتدی با کاتالیزورهای فلزی استفاده شده است که باعث افزایش سینتیک کاهش و افزایش ظرفیت خاص کاتد می شود. منگنز، کبالت، روتنیوم، پلاتین، نقره یا مخلوطی از کبالت و منگنز از کاتالیزورهای فلزی بالقوه هستند. تحت برخی شرایط کاتدهای کاتالیز شده منگنز بهترین عملکرد را داشتند، با ظرفیت خاص 3137 mA·H/g و کاتدهای کاتالیز شده با کبالت با بهترین ظرفیت 2414 mA·H/g دومین بهترین ها را داشتند. بر اساس اولین مدل سازی مقیاس منافذ باتری های لیتیوم - هوا، ساختار ریز کاتد به طور قابل توجهی بر ظرفیت باتری هم در رژیم های غیر مسدود کننده منفذ و هم در منافذ منفذ تأثیر می گذارد. بیشتر محدودیت های باتری Li-air در کاتد است که منبع مزایای بالقوه آن نیز می باشد. اکسیژن اتمسفر باید در کاتد وجود داشته باشد، اما آلودگی هایی مانند بخار آب می تواند به آن آسیب برساند. تخلیه ناقص به دلیل انسداد کاتد کربن متخلخل با محصولات تخلیه مانند پراکسید لیتیوم (در طرح های غیر عادی) جدی ترین است. کاتالیزورها در ایجاد هسته ترجیحی Li2O2 بیش از Li2Oترجیح داده شده اند ،که با توجه به لیتیوم برگشت پذیر نیست. عملکرد Li–air با کارایی واکنش در کاتد محدود می شود، زیرا بیشتر افت ولتاژ در آنجا اتفاق می افتد. چندین ترکیب شیمیایی مورد ارزیابی قرار گرفته است که توسط الکترولیت آنها متمایز شده است. این بحث بر روی الکترولیت های آلی و آبی متمرکز است زیرا الکتروشیمی حالت جامد به خوبی درک نشده است.
در یک سلول با الکترولیت آپروتیک اکسیدهای لیتیوم از طریق کاهش در کاتد تولید می شود:
Li+ + e− +O2 + *→ LiO2*
Li+ + e− +LiO2*→Li2O2* جایی که "*" یک سایت سطح در Li2O2 را نشان می دهد که در آن رشد ادامه می یابد، که در اصل یک جای خالی Li2O2 در سطح است. اکسیدهای لیتیوم در الکترولیت های غیرقابل حل نیستند ، که منجر به گرفتگی کاتد می شود. یک MnO2 کاتد آرایه نانوسیم تقویت شده توسط ویروس باکتریوفاژ اصلاح شده ژنتیکی M13 دو تا سه برابر چگالی انرژی باتری های لیتیوم یون دوران 2015 را ارائه می دهد. این ویروس اندازه آرایه نانوسیم را که عرض آن حدود 80 نانومتر است، افزایش داد. سیم های حاصل دارای سطح سنبله ای بودند. سنبله ها سطح بیشتری را برای میزبانی از سایت های واکنش ایجاد می کنند. روند ویروسی به جای سیم های جدا شده، باعث ایجاد ثبات در الکترود یک ساختار سه بعدی متقابل می شود. روند ویروسی مبتنی بر آب است و در دمای اتاق انجام می شود. 3-2- الکترولیت باتری های Li–air بر روی چهار الکترولیت متمرکز شده است: اسیدی آبی، قلیایی آبی، غیرآبی دارای پروتون آزاد و آلی. در سلول با الکترولیت آبی کاهش در کاتد همچنین می تواند هیدروکسید لیتیوم تولید کند:
3-2-1- باتری لیتیم آبی
یک باتری لیتیوم آبی از یک آند فلز لیتیوم، یک الکترولیت آبی و یک کاتد کربن متخلخل تشکیل شده است. الکترولیت آبی نمک های لیتیوم محلول در آب را ترکیب می کند. از مسئله گرفتگی کاتد جلوگیری می کند زیرا محصولات واکنش در آب محلول هستند. طرح آبی از پتانسیل تخلیه عملی بالاتری نسبت به نمونه قیمتی خود برخوردار است. با این حال، فلز لیتیوم به شدت با آب واکنش نشان می دهد و بنابراین طرح آبی به یک رابط الکترولیت جامد بین لیتیوم و الکترولیت نیاز دارد. معمولاً از سرامیک یا شیشه رسانای لیتیوم استفاده می شود، اما رسانایی به طور کلی کم است (به ترتیب 10−3 S/cmدر دمای محیط).
الکترولیت اسیدی
2Li + ½ O2 +2H+→ 2Li++ H2O
یک پایه مزدوج در واکنش نقش دارد. حداکثر تئوری انرژی خاص و خاصیت چگالی انرژی سلول Li–air به ترتیب 1400 W·h/kg و 1680 W·h/l است.
3-2-3- الکترولیت آبی قلیایی
2Li + ½ O2 + H2O→ 2LiOH
مولکول های آب در واکنش های اکسایش کاتد هوا نقش دارند. حداکثر تئوری انرژی خاص و سلول مخصوص چگالی انرژی به ترتیب 1300 W·h/kg و 1520 W·h/l است.
مواد جدید کاتدی باید محل استقرار مقادیر قابل توجهی از LiO2, Li2O2 و یا LiOH را تشکیل دهند.
بدون اینکه منافذ کاتد را مسدود کرده و از کاتالیزورهای مناسب برای عملی سازی واکنشهای الکتروشیمیایی استفاده کند.
مواد سیستم منافذ دوگانه امیدوار کننده ترین ظرفیت انرژی هستند.
اولین سیستم منافذ به عنوان فروشگاه محصولات اکسیداسیون عمل می کند.
دومین سیستم منافذ به عنوان انتقال اکسیژن عمل می کند.
3-2-4- آپروتیک (آلی)
ابتدا باتری های غیر آبی Li-air نشان داده شدند. آنها معمولاً از حلالهای کربنات اتیلن + کربنات پروپیلن با نمکهای LiPF6 یا Li bis-sulfonimide مانند باتریهای لیتیوم یون معمولی استفاده می کنند، البته با الکترولیت مایع و ژل دار. اختلاف ولتاژ در شارژ و تخلیه جریان ثابت معمولاً بین 1.3 و 1.8 ولت است (با OCP حدود 4.2 ولت) حتی در جریان های کم مضحک مانند 0.01–0.5 mA/cm² و 50-500 میلی آمپر / گرم C در الکترود مثبت
با این حال، حلال های کربنات بخاطر اضافه ولتاژ زیاد در هنگام شارژ، تبخیر شده و اکسید می شوند. حلالهای دیگری مانند گلیم های درپوشیده شده، DMSO ، دی متیل استامید و مایعات یونی در نظر گرفته شده اند. کاتد کربن در هنگام شارژ بالاتر از +3.5 V v Li اکسید شده و Li2CO3 را تشکیل می دهد، که منجر به کاهش ظرفیت برگشت ناپذیر می شود.
بیشترین تلاش ها شامل مواد آپروتیک بود که متشکل از یک آند فلز لیتیوم، یک الکترولیت آلی مایع و یک کاتد کربن متخلخل است. الکترولیت را می توان از هر مایع آلی که قادر به حل نمک های لیتیوم است مانند
LiPF6, LiAsF6, LiN(SO2CF3) 2, LiSO3CF3) ساخت.
اما معمولاً از کربناتها، اترها و استرها تشکیل شده است. کاتد کربن معمولاً از یک ماده کربنی با سطح بالا با کاتالیزور اکسید فلز با ساختار نانو (معمولاً MnO2 یا Mn3O4) ساخته می شود.
یک مزیت عمده تشکیل خود به خودی مانع بین آند و الکترولیت است (مشابه سد تشکیل شده بین الکترولیت و آندهای کربن لیتیوم در باتری های لیتیوم یونی) که از فلز لیتیوم در برابر واکنش بیشتر با الکترولیت محافظت می کند. اگرچه قابل شارژ است، Li2O2 تولید شده در کاتد به طور کلی در الکترولیت آلی نامحلول است و منجر به تجمع در طول رابط کاتد / الکترولیت می شود. این باعث می شود کاتدهای موجود در باتری های آپروتیک در معرض گرفتگی و افزایش حجم باشند که به تدریج رسانایی را کاهش داده و عملکرد باتری را تخریب می کند. مسئله دیگر این است که الکترولیت های آلی قابل اشتعال هستند و در صورت آسیب سلول می توانند مشتعل شوند.
اگرچه اکثر مطالعات موافق Li2O2 هستند. محصول تخلیه نهایی باتری های غیر آبی Li-O2 است، شواهد قابل توجهی نشان می دهد که شکل گیری آن به عنوان یک کاهش مستقیم 2 الکترون به پراکسید 2 O2−
انجام نمی شود (که مسیر مشترک کاهش O2 در آب بر روی کربن است) بلکه از طریق کاهش یک الکترون به سوپراکسید O2− ، به دنبال عدم تناسب آن.
2LiO2⇌Li2O2+O2
سوپراکسید (O−2)به دلیل هسته ای بودن، بنیادی بودن و پتانسیل اکسایش (Redox) بالا ، به طور سنتی به عنوان یک واسطه خطرناک در باتری های اکسیژن غیرعادی مورد توجه قرار گرفته است. با این حال، گزارش ها نشان می دهد که LiO2 در حین تخلیه واسطه است پراکسید 2O2) (Li می تواند به عنوان محصول تخلیه نهایی مورد استفاده قرار گیرد ، به طور بالقوه با عمر چرخه بهبود یافته، البته با انرژی خاص کمتر (وزن باتری کمی سنگین تر). در واقع، نشان داده شد که تحت شرایط خاص، سوپراکسید می تواند در مقیاس 20-70 ساعت در دمای اتاق پایدار باشد. با از دست دادن ظرفیت برگشت ناپذیر با عدم تناسب LiO2 در باتری شارژ شده، رسیدگی نشد.
به نظر می رسد Pt / C بهترین الکتروکاتالیست برای تکامل O2 و Au / C برای کاهش O2 در هنگام تولید 2O2 Li است. با این وجود ، عملکرد باتری های لیتیوم-هوا قابل شارژ با الکترولیت های غیر آبی توسط واکنش های موجود بر روی الکترود اکسیژن، به ویژه توسط تکامل O2 محدود می شود. الکترودهای متناوب متخلخل هوا از کربن قادر به تأمین ظرفیت های mAh / g و mAh/cm2نیستند نرخ در اندازه مورد نیاز برای باتری های با چگالی انرژی بسیار بالا برای برنامه های کاربردی EV. ظرفیت (در mAh/cm2) و عمر چرخه باتری های غیر آبی Li-O2 با رسوب نامحلول و رسانای الکترونیکی ضعیف محدود می شود. مراحل LiOx هنگام تخلیه.
( Li3O4پیش بینی می شود هدایت Li+ بهتری از فاز LiO2 و Li2O2 باشد. این امر باعث می شود که انرژی ویژه عملی باتری های LiO2 به مراتب کوچکتر از پیش بینی سطح واکنش دهنده باشد. به نظر می رسد که این پارامترها به حد مجاز خود رسیده اند و تنها از روش های جایگزین انتظار پیشرفت بیشتر است.
2-3-5- مخلوط آبی - آلی
طراحی باتری های آبی-آلی یا مخلوط باتری Li-air تلاش می کند تا مزایای طراحی باتری های آلی و آبی را متحد کند. ویژگی مشترک در طراحی های ترکیبی، الکترولیت دو بخشی (یک قسمت آبی و یک قسمت غیر متحرک) است که توسط غشا رسانای لیتیوم متصل می شود. آند در حالی که کاتد با طرف آبی در تماس است از طرف آلی قرار دارد. سرامیک رسانای لیتیوم معمولاً به عنوان غشایی که به دو الکترولیت می پیوندد استفاده می شود.
یکی از این روشهای جایگزین است که امکان ترکیب آند فلز لیتیوم با کاتد آبی را فراهم می کند. الکترولیت های جامد سرامیکی (CSEs) از خانواده NASICON (به عنوان مثال،
e.g., Li1−xAxM2−x(PO4)3 A ∈ [Al, Sc, Y] and M ∈ [Ti, Ge]) مورد مطالعه قرار گرفته است.
سازگار با آب در pH قلیایی و داشتن یک پنجره الکتروشیمیایی بزرگ )مطابق شکل ) ، هدایت یونی Li+ پایین آنها در نزدیکی دمای اتاق (< 0.005 S/cm, >85 Ω cm2) آنها را برای برنامه های ذخیره سازی انرژی در خودرو و ثابت که تقاضای کم هزینه دارند ، نامناسب می کند (یعنی تراکم جریان بیش از 100 میلی آمپر در سانتی متر مربع). علاوه بر این، هر دو Ti و Ge توسط فلزی Li کاهش می یابند، و یک لایه میانی بین الکترود سرامیکی و الکترود منفی مورد نیاز است. در مقابل، الکترولیت های پلیمری جامد (SPEs) می توانند هدایت بالاتری را در هزینه عبور متقاطع از آب و سایر مولکولهای کوچک که نسبت به لیز فلزی واکنش نشان می دهند، فراهم کنند. از جمله غشاهای عجیب و غریب در نظر گرفته شده برای باتری های Li-O2 ، سیلیکون تک بلوری است.
در سال 2015 محققان طرحی را اعلام کردند که از گرافن بسیار متخلخل برای آند ، الکترولیت لیتیوم بیس (تری فلوئورومتیل) سولفونیمیلید / دی متیو اکیزتان با آب و یدید لیتیوم اضافه شده برای استفاده به عنوان "واسطه" استفاده می کند. الکترولیت بجای پراکسید لیتیوم (Li2O2) هیدروکسید لیتیوم (LiOH) در کاتد تولید می کند.
2) این نتیجه بهره وری انرژی 93 درصد (فاصله ولتاژ 2/0) و بیش از 2 هزار بار چرخه را با تأثیر کم بر خروجی ارائه می دهد. با این حال، طراحی به جای هوای محیط به اکسیژن خالص نیاز داشت.
2-3-6- استفاده از الکترولیت جامد
یک طراحی باتری حالت جامد از نظر ایمنی جذاب است و احتمال احتراق در پارگی را از بین می برد. باتری های لیتیوم حالت جامد کنونی از یک آند لیتیوم ، یک الکترولیت سرامیک ، شیشه یا شیشه و سرامیک و یک کاتد کربن متخلخل استفاده می کنند. آند و کاتد معمولاً توسط کامپوزیت های پلیمری و سرامیکی از الکترولیت جدا می شوند که انتقال بار را در آند افزایش داده و کاتد را به الکترولیت به صورت الکتروشیمیایی جفت می کنند. کامپوزیت های پلیمر و سرامیک باعث کاهش امپدانس کلی می شوند. اشکال اصلی در طراحی باتری حالت جامد، رسانایی کم اکثر الکترولیت های سرامیک شیشه ای است. رسانایی یونی رساناهای یونی سریع لیتیوم پایین تر از گزینه های الکترولیت مایع است.
جستارهای وابسته
منابع
- مشارکتکنندگان ویکیپدیا. «Lithium–air battery». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲ اردیبهشت ۱۳۹۳.