اوروتیدین '۵-فسفات دکربوکسیلاز
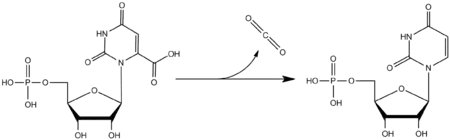
اوروتیدین '۵-فسفات دکربوکسیلاز (انگلیسی: Orotidine 5'-phosphate decarboxylase) یا اوروتیدیلات دکربوکسیلاز یک آنزیم است که در بیوسنتز پیریمیدین نقش دارد. این آنزیم در واکنش کربوکسیلزدایی از کلروتیدین ۵-مونوفسفات (OMP) و تبدیل کردن آن به اوریدین مونوفسفات (UMP) نقش دارد. عملکرد این آنزیم جهت ساخت نوکلئوتیدهای جدید اوریدین تریفسفات، سیتیدین تری فسفات و تیمیدین تریفسفات ضروری است. این آنزیم به سبب قابلیتهای کاتالیزوری شدید و همچنین سودمندیاش بهعنوان یک نشانگر زیستی در مهندسی و ساخت گونههای مخمر، یکی از اهداف مکرر پژوهشی بودهاست.
| اوروتیدین '۵-فسفات دکربوکسیلاز | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 آنزیم اوروتیدین '۵-فسفات دکربوکسیلاز در باکتری اشریشیا کلی.[1] | |||||||||
| شناساگرها | |||||||||
| شمارهٔ ایسی | 4.1.1.23 | ||||||||
| شمارهٔ سیایاس | 9024-62-8 | ||||||||
| پایگاههای داده | |||||||||
| اینتنز | نمایش اینتنز | ||||||||
| برندا | مدخل برندا | ||||||||
| اکسپسی | نمایش NiceZyme | ||||||||
| کیایجیجی | مدخل کیایجیجی | ||||||||
| متاسایک | گذرگاه سوختوساز | ||||||||
| پریام | نمایه | ||||||||
| ساختارهای پیدیبی | RCSB PDB PDBe پیدیبیسام | ||||||||
| هستیشناسی ژن | AmiGO / QuickGO | ||||||||
| |||||||||
پژوهشهای عمیق و گستردهای دربارهٔ نحوهٔ عملکرد این آنزیم تاکنون انجام شدهاست. اوروتیدین '۵-فسفات دکربوکسیلاز یک کاتالیزور بهشدت مؤثر و قوی است که سرعت واکنش شیمیایی را ۱۰۱۷ برابر میکند.[2] برای درک بهتر این موضوع، کافی است بدانید که واکنش شیمیایی مورد نظر بدون حضور این آنزیم در حدود ۷۸ میلیون سال و با حضور این آنزیم ظرف تنها ۱۸ میلیثانیه انجام میشود. این اثربخشی آنزیمی از آن جهت جالبتر میشود که بدانیم اوروتیدین '۵-فسفات دکربوکسیلاز، از هیچگونه کوفاکتوری استفاده نکرده و هیچگونه «جایگاه فلزی» (metal site)[3] و «گروه افزایشی یا پروستتیک» (prosthetic group)[4] هم ندارد. عمل کاتالیزوری این آنزیم تنها وابسته به حضور چند اسید آمینه باردار است که در جایگاههای فعال آنزیمی قرار میگیرند.
این آنزیم در مخمرها و باکتریها، یک آنزیم تکمنظوره است. اما در پستانداران، جزئی از یک پروتئین واحد با دو عمل کاتالیزوری مختلف است. این آنزیم دومنظوره اوریدین منو فسفات سنتاز نام دارد و علاوه بر واکنش پیشتر یادشده در ساخت نوکلئوتیدهای پیریمیدین، سبب تسهیل انتقالِ ریبوز ۵-فسفات از فسفوریبوزیل پیروفسفات به اوروتیک اسید و تشکیل کلروتیدین ۵-مونوفسفات (OMP) میشود. در جاندارانی که OMP را مصرف میکنند، این واکنش توسط اوروتات فسفوریبوزیلترانسفراز تسهیل میشود.[5]
منابع
- پیدیبی 1EIX; Harris P, Navarro Poulsen JC, Jensen KF, Larsen S (April 2000). "Structural basis for the catalytic mechanism of a proficient enzyme: orotidine 5'-monophosphate decarboxylase". Biochemistry. 39 (15): 4217–24. doi:10.1021/bi992952r. PMID 10757968.
- Radzicka A, Wolfenden R (January 1995). "A proficient enzyme". Science. 267 (5194): 90–3. doi:10.1126/science.7809611. PMID 7809611.
- Miller BG, Smiley JA, Short SA, Wolfenden R (August 1999). "Activity of yeast orotidine-5'-phosphate decarboxylase in the absence of metals". J. Biol. Chem. 274 (34): 23841–3. doi:10.1074/jbc.274.34.23841. PMID 10446147.
- Miller BG, Wolfenden R (2002). "Catalytic proficiency: the unusual case of OMP decarboxylase". Annu. Rev. Biochem. 71: 847–85. doi:10.1146/annurev.biochem.71.110601.135446. PMID 12045113.
- Yablonski MJ, Pasek DA, Han BD, Jones ME, Traut TW (1996). "Intrinsic activity and stability of bifunctional human UMP synthase and its two separate catalytic domains, orotate phosphoribosyltransferase and orotidine-5'-phosphate decarboxylase". J Biol Chem. 271 (18): 10704–10708. doi:10.1074/jbc.271.18.10704. PMID 8631878.
- مشارکتکنندگان ویکیپدیا. «Orotidine 5'-phosphate decarboxylase». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۷ ژانویه ۲۰۲۱.