استرپتوکوک پیوژنز
استرپتوکوک پیوژنز(به لاتین: Streptococcus pyogenes) کوکسیهای گرم مثبتی هستند که در گروه A طبقه بندی لنسفیلد قرار میگیرد. استرپتوکوک پیوژنز هنگامی که بر روی آگار خون دار رشد میکند، بتا همولیتیک است[1]. استرپتوکوکها از نظر تولید آنزیم کاتالاز، منفی هستند. مدت زمان انکوباسیون باکتری، ۱ تا ۳ روز به طول میانجامد. این طور تصور میشود که سالیانه ۷۰۰ میلیون عفونت توسط این باکتری ایجاد میشود که ۶۵۰ هزار مورد از آنها شدید هستند. میزان مرگ و میر عفونتهای ایجاد شده توسط استرپتوکوک پیوژنز حدود ۲۵% است[2].
| استرپتوکوک پیوژنز | |
|---|---|
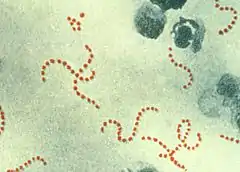 | |
| استرپتوکوک پیوژنز با بزرگنمایی ۹۰۰ برابر. | |
| آرایهشناسی | |
| فرمانرو: | یوباکتریا |
| شاخه: | فیرمیکوتس |
| رده: | کوکسی (کوکوسها) |
| راسته: | لاکتوباسیلالس |
| تیره: | استرپتوکوکاسیه |
| سرده: | استرپتوکوک |
| گونه: | استرپتوکوک پیوژنز |
| نام علمی | |
| Streptococcus pyogenes Rosenbach 1884 | |
سروتیپ بندی
در سال ۱۹۲۸، ربکا لنسفیلد با استفاده از پروتئین M (پروتئین سطحی و فاکتور بیماریزایی مهم در استرپتوکوک پیوژنز)، روشی را برای سروتیپ بندی (سروتایپینگ) استرپتوکوک پیوژنز ابداع نمود[3]. در سال ۱۹۴۶، لنسفیلد، طبقهبندی سرولوژیکی بر اساس پروتئین سطحی T را طراحی کرد[4]. تاکنون ۱۰۰ سروتیپ T و ۲۰ سروتیپ M در استرپتوکوک پیوژنز شناخته شدهاست.
بیماریزایی
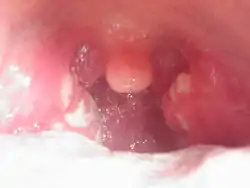
این باکتری بیماریهای مهمی را در انسان ایجاد میکند. فارنژیت (گلودرد چرکی)، زرد زخم، باد سرخ، سلولیت، فاسئیت نکروزان (قانقاریا) از بیماریهای مهمی هستند که توسط استرپتوکوک پیوژنز ایجاد میشوند. برخی از سویههای باکتری توکسینهایی (سمها) تولید میکنند که در ایجاد بیماری نقش دارند مانند مخملک و سندرم شوک توکسیک[1]. استرپتوکوک پیوژنز میتواند در بیماریهای خود ایمنی نقش داشته باشد. علت این امر را شباهت بافتهای بدن با ساختار پروتئین M میدانند. آنتی بادیهایی که علیه پروتئین M ایجاد میشود با بافتهای خود بدن واکنش میدهد و در نتیجه بیماری خود ایمنی ایجاد میشود. تب روماتیسمی (قلب) و گلومرولونفریت (کلیه)، دو بیماری خود ایمنی مرتبط با باکتری هستند[1].
فاکتورهای بیماریزایی
استرپتوکوک پیوژنز، فاکتورهای بیماریزایی مختلفی را تولید میکند. این باکتری با استفاده از این فاکتورهای بیماریزایی میتواند به سلولهای میزبان بچسبد، از سیستم ایمنی میزبان فرار کند یا در بدن پخش شود[5].
- کپسول:
کپسول از هیالورونیک اسید تشکیل شدهاست و موجب مقاومت باکتری نسبت به هضم شدن در برابر نوتروفیلها خواهد بود.
- پروتئین M:
پروتئین M موجب مهار اپسونیزاسیون توسط سیستم کمپلمان میزبان میشود. همچنین میتواند با اتصال به فیبرینوژن، اپسونیزاسیون را مهار کند. با این وجود، این پروتئین نقطه ضعف باکتری است زیرا آنتی بادیهای تولید شده علیه آن، موجب به دام افتادن باکتری توسط فاگوسیتها (گلبولهای سفید) خواهد شد. هر سویه، پروتئین M ویژه خود را تولید میکند. از پروتئین M برای سروتیپ بندی سویههای استرپتوکوک پیوژنز نیز استفاده میشود.
- پروتئین T:
پروتئین T (مقاوم به تریپسین)، پروتئین ثانویه ویژه تیپ است که شاخص اپیدمیولوژیکی مفیدی برای سویههایی است که پروتئین M را بیان نمیکنند. عملکرد دقیق پروتئین اخیر هنوز ناشناخته باقیماندهاست. این آنتی ژن ارتباطی با بیماری زایی استرپتوکوکها ندارد. ماده T به اسید و حرارت حساس است. از ماده T برای تمایز تیپهای مشخصی از استرپتوکوکها به وسیله آگلوتیناسیون با آنتی بادی اختصاصی استفاده میکنند.
- استرپتولیزین O:
نوعی اگزوتوکسین است که در همولیز گلبولهای قرمز (بتا همولیز) نقش دارد. آنتی بادی تولید شده علیه استرپتولیزین O را میتوان در بدن شناسایی کرد. آنتی استرپتولیزین O یا به اختصار ASO بیانگر عفونت اخیر با استرپتوکوک پیوژنز است.
- استرپتولیزین S:
نوعی اگزوتوکسین است که دارای فعالیت کاردیوتوکسیک (اثر بر قلب) میباشد. استرپتولیزین S، ایمنی زا نیست و در برابر اکسیژن پایدار است (بر خلاف استرپتولیزین O). این توکسین، بسیاری از ردههای سلولی مثل نوتروفیلها، پلاکتها و اندامها را تحت تأثیر قرار میدهد.
- اگزوتوکسین تب زای استرپتوکوکی:
SpeA و SpeC، سوپرآنتی ژنهایی هستند که توسط این باکتری تولید میشوند. آنها، مسئول ایجاد راش در تب مخملک و بسیاری از علائم سندرم شوک توکسیک استرپتوکوکی میباشند.
- استرپتوکیناز:
آنزیمی است که پلاسمینوژن را فعال کرده و به پلاسمین تبدیل میکند.پلاسمین آنزیم فعالی است که موجب هضم فیبرین و سایر پروتئینها میگردد. استرپتوکیناز در هضم فیبرین و سایر پروتئینها نقش دارد.
- هیالورونیداز:
از مهمترین فاکتورهای گسترش باکتری در بدن است. هیالورونیداز، اسید هیالورونیک (مهمترین بخش بافت همبند) را تجزیه میکند.
- استرپتودورناز:
هر سویه میتواند تا ۴ نوع آنزیم DNase تولید کند. استرپتودورناز از به دام افتادن باکتری در دامهای خارج سلولی نوتروفیلی (neutrophil extracellular traps) که از جنس DNA هستند، جلوگیری میکند. آنتی بادیهای تولید شده علیه DNaseB، به عنوان یک شاخص مهم برای تشخیص عفونتهای پوستی استرپتوکوکی مطرح میباشد.
- C5a پپتیداز:
C5a (کموتاکسین قوی نوتروفیلی) را تجزیه میکند. در مراحل اولیه عفونت از مهاجرت نوتروفیلها به سمت باکتری جلوگیری میکند.
تشخیص
گرفتن سوآب از گلو (بیماران مبتلا به گلودرد چرکی) و کشت بر روی محیط آگار خون دار و استفاده از دیسک باسیتراسین، یکی از معمولترین روشهای تشخیص آزمایشگاهی باکتری است. باکتری بر روی محیط آگار خون دار، بتا همولیتیک است و به باسیتراسین حساس میباشد. واکنش تست کاتالاز بر روی باکتری کشت یافته در محیط غیر خون دار، منفی است. باکتری از نظر تستهای CAMP و هیپورات، منفی است. همچنین میتوان با استفاده از تستهای سرولوژیکی، آنتی ژن اختصاصی گروه A را به راحتی در سویه مشکوک تشخیص داد[6].
درمان
درمان انتخابی، پنی سیلین است که حداقل به مدت ۱۰ روز تجویز میگردد[7]. تاکنون هیچ سویه مقاوم به پنی سیلین در استرپتوکوک پیوژنز کشف نشدهاست هرچند از سال ۱۹۸۵، گزارشهایی از سویههای تحمل کننده پنی سیلین ارائه شدهاست[8]. باکتری به ماکرولیدها، کلرامفنیکل و تتراسایکیلین حساس است اما میزان مقاومت در سویهها نسبت به آنتی بیوتیکهای اخیر، بیشتر میباشد.
پیشگیری
در حال حاضر، هیچ نوع واکسنی برای پیشگیری از عفونت ساخته نشدهاست هرچند پژوهشها در این زمینه ادامه دارد.
جستارهای وابسته
منابع
- Ryan KJ, Ray CG (editors) (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 0-8385-8529-9.
- Jim Dwyer (July 11, 2012). "An Infection, Unnoticed, Turns Unstoppable". The New York Times. Retrieved July 12, 2012.
- Lancefield RC (1928). "The antigenic complex of Streptococcus hemolyticus". J Exp Med 47 (1): 9–10. doi:10.1084/jem.47.1.91.
- Lancefield RC, Dole VP (1946). "The properties of T antigen extracted from group A hemolytic streptococci". J Exp Med 84 (5): 449–71. doi:10.1084/jem.84.5.449.
- Patterson MJ (1996). Streptococcus. In: Baron's Medical Microbiology (Baron S et al. , eds.) (4th ed.). Univ of Texas Medical Branch. ISBN 0-9631172-1-1.
- Kellogg JA, Bankert DA, Elder CJ, Gibbs JL, Smith MC (September 2001). "Identification of Streptococcus pneumoniae revisited". J. Clin. Microbiol. 39 (9): 3373–5. PMC 88350. PMID 11526182.
- Falagas ME, Vouloumanou EK, Matthaiou DK, Kapaskelis AM, Karageorgopoulos DE (2008). "Effectiveness and safety of short-course vs long-course antibiotic therapy for group a beta hemolytic streptococcal tonsillopharyngitis: a meta-analysis of randomized trials". Mayo Clin Proc 83 (8): 880–9. doi:10.4065/83.8.880. PMID 18674472.
- Kim KS, Kaplan EL (1985). "Association of penicillin tolerance with failure to eradicate group A streptococci from patients with pharyngitis". J Pediatr 107 (5): 681–4. doi:10.1016/S0022-3476(85)80392-9. PMID 3903089.