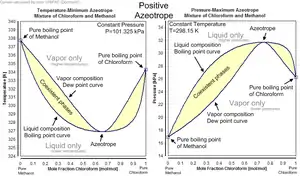
آزئوتروپ
آزئوتروپ(به انگلیسی: Azeotrope) در اصطلاح ترمودینامیک شیمیایی به مخلوطهایی گفته میشود که با تقطیر ساده قابل جداسازی نباشند. قانون رائولت در شرایط تعادل مایع-بخار و برای یک محلول ایده ال بیان میکند که فشار یک بخار وابسته است به ترکیبات شیمیایی آنها و تجزیه مولی ذراتش. در نتیجه فشار بخار با کسر مولی ذرات رابطهای خطی خواهد داشت. اما در مخلوطهای آزئوتروپ این رابطه از فرم خطی خارج میشود.
- انحراف منفی:در این حالت نمودار فشار-کسر مولی دارای مینیم و نمودار دما-کسر مولی دارای ماکسیمم است. این حالت نشانگر غلبه نیروهای بین مولکولهای غیر مشابه بر نیروی بین مولکولهای مشابه است.
- انحراف مثبت: در این حالت نمودار فشار-کسر مولی دارای ماکسیمم و نمودار دما-کسر مولی دارای مینیمم است. این حالت نشانگر غلبه نیروهای بین مولکولهای مشابه بر نیروی بین مولکولهای غیر مشابه است.
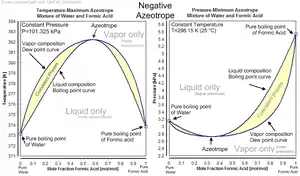
آزئوتروپ منفی-مخلوط فرمیک اسید و آب
جستارهای وابسته
منابع
- Smith, Joseph Mauk; Vanness, H.C (2001). ThermodynamicsIntroduction to Chemical Engineering. McGraw-Hill. ISBN 0-07-240296-2.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.