کاربردهای تصویربرداری مولکولی در امآرآی
تصویربرداری مولکولی
- تصویربرداری مولکولی زمینهای نسبتاً جدید و هیجان انگیز در تصویربرداری تشخیصی است که میتوان آن را به صورت شناسایی و اندازهگیری In vivo فرآیندهای بیولوژیکی در سطح سلولی و مولکولی در موجودات زنده توصیف کرد. مفهوم و کاربرد این روش تصویربرداری چند دهه است که مطرح شده و شروع آن با تصویربرداری هستهای هدفمند بودهاست. در تصویربرداری مولکولی از پروبهایی به نام بیومارکر استفاده میشود که امکان شناسایی بخش خاصی را فراهم میسازند. این مواد با محیط اطراف خود واکنش میدهند و از اثرات این واکنش در تصویرسازی استفاده میشود.
- از آنجا که تصویربرداری مولکولی امکان مشاهده ساختارها و فرآیندها را در سطح مولکولی فراهم میکند و پتانسیل تبدیل شدن به نوعی از تصویربرداری تشخیصی از طریق ایجاد امکان توصیف و شناسایی فرآیندهای بیماری با جزئیات به مراتب بیشتر را دارد، امروزه زمینههای تحقیقاتی بسیاری در ارتباط با تصویربرداری مولکولی به وجود آمدهاست. بسیاری از پژوهشها به دنبال یافتن راهی برای تشخیص زود هنگام بیماریها با توجه به آرایش مولکولها پیش از بروز نشانههای معمول بیماری هستند. بخش دیگری از تحقیقات بر مطالعه ژنها برای یافتن بیومارکرهای جدید تمرکز دارند.
- این نوع از تصویربرداری در درجه اول باید از قدرت تفکیک مکانی بالا برخوردار باشد که مکانیابی مناسب در بدن ممکن شود و در درجه دوم از حساسیت بالا برخوردار باشد که بتواند نحوه توزیع مولکولها و تمرکز آنها را به خوبی گزارش کند.
کاربردهای تصویربرداری مولکولی
- امروزه استفاده از تصویربرداری مولکولی محدود به کاربردهای پیش کلینیکی و تحقیقاتی نیست بلکه روز به روز بر کاربرد آن در کارهای کلینیکی و درمانی افزوده میشود. در این زمینه میتوان به کاربرد تصویربرداری مولکولی در بیماریهای قلبی و عروقی، سرطان و اختلالات نورولوژیک اشاره کرد.
- در مورد بیماریهای قلبی عروقی، تصویربرداری مولکولی امکان مطالعه دقیق و شخص به شخص بیماری و مدیریت آن را در مشکلاتی نظیر گرفتگی عروق، آریتمی، پس زدن عضو پیوندی، تشکیل لخته در عروق و ایست قلبی، فراهم میآورد.
- در ارتباط با سرطان، تصویربرداری مولکولی در کنار امکان مکانیابی دقیق تومور، میتواند ویژگیهایی از آن را مشخص سازد و سیر پیشرفت بیماری و متاستاز آن به نواحی مختلف بدن را بیان کند. در این بیماری، تصویربرداری مولکولی نقش مهمی در درمان و ارزیابی پاسخ بیمار به درمان ایفا میکند. به عنوان مثال از FDG به عنوان یک پروب مولکولی برای تشخیص سرطان لنف استفاده شدهاست.
- در اختلالات نورولوژیک، تصویربرداری مولکولی نقش مهمی در تشخیص، طبقهبندی و ارزیابی درمان ایفا میکند. استفاده از این نوع تصویربرداری در کاربردهای گوناگون این نوع اختلالات، از مشکلات حرکتی در بیماری پارکینسون تا مشکلات روانی در آلزایمر رواج یافتهاست.
- از دیگر کاربردهای تصویربرداری مولکولی استفاده از آن در تشخیص بافتهایی است که دچار کمبود اکسیژن شدهاند. این مشکل در هنگام سکته و دیگر مشکلات قلبی یا به واسطه برخی تومورها اتفاق میافتد. با رشد تومور، مقدار اکسیژن رسیده توسط عروق، پاسخگوی نیاز آن نیست. اما متأسفانه تومور با تغییراتی که در ساختار سلولها ایجاد میکند، میتواند خود را با این کمبود اکسیژن وفق دهد. این تغییرات مقاومت تومور در مقابل شیمی درمانی را افزایش میدهد و بنابراین روند درمانی مناسب قابل انجام نخواهد بود. در دهه اخیر با استفاده از تصویربرداری مولکولی کارهای زیادی در زمینه تشخیص و درمان این مشکل صورت گرفتهاست.
مدالیتههای مورد استفاده در تصویربرداری مولکولی
- در تصویربرداری مولکولی از بیشتر مدالیتههای موجود در تصویربرداری پزشکی استفاده میشود. معمولترین روشهایی که برای تصویربرداری مولکولی مورد استفاده قرار گرفتهاند، روشهای هستهای (PET و SPECT) و MRI بودهاست. در سالهای اخیر، اولتراسوند و تکنیکهای نوری نیز در این زمینه به کار گرفته شدهاند. برای استفاده از این مدالیتهها در ابعاد کوچک و رسیدن به ویژگیهای مطلوب، نیاز به بهینهسازی و تلفیق آنها وجود دارد. در حقیقت معمولاً تصویربرداری مولکولی یک تصویربرداری چند مدالیته است تا بتواند با استفاده از تکنیکهای موجود رزولوشن مناسب را در کنار حساسیت بالا فراهم آورد. از رایجترین ترکیبهای چند مدالیته میتوان به SPECT/CT و PET/MRI اشاره کرد.
- PET/MRI:
- با تلفیق این دو مدالیته میتوان به رزولوشن بالا در کنار حساسیت بالا در ردیابی رسید. به عبارت دیگر از ویژگیهای مفید هر دو مدالیته تواماً بهرهبرداری نمود. یک ویژگی جالب که در این روش ایجاد میشود این است که رزولوشن مکانی PET افزایش مییابد، چرا که با قرار گرفتن در میدان مغناطیسی طول موج تولیدی پوزیترونها کاهش مییابد. از طرف دیگر دادههای کمی PET با استفاده از دادههای MRI بهبود مییابند.
- SPECT/CT:
- در این روش از همان تصویربرداری هستهای معمولی همراه با بازسازی با استفاده از نقش کردن استفاده میشود. این مدالیته توانایی مشاهده رادیو ردیابها را دارد و ویژگی دیگر جالب آن امکان تصویربرداری از گیرندهها است. هم چنین این مدالیته میتواند از چند رادیو ردیاب با فوتونهایی با انرژی متفاوت به صورت همزمان تصویرسازی کند. این مدالیته از رزولوشن مکانی بالایی برخوردار است و میتواند تصاویر سه بعدی با دقت ۵۰ تا ۱۰۰ میکرومتر مکعب را بدست دهد. بیشترین استفاده از CT در بدست آوردن اطلاعات آناتومیکی دقیق است. توسط این اطلاعات میتوان تضعیف رخ داده در SPECT را تصحیح کرد.
- برخلاف روشهای تصویربرداری سنتی که عمدتاً متکی بر انطباق و تفسیر تفاوتهای موجود در کنتراست تصویر بین بافتهای سالم و پاتولوژیک هستند و آناتومی بیماری را نمایش میدهند، تصویربرداری مولکولی به دنبال بهبود دقت تشخیصی از طریق به تصویر کشیدن فرآیندها یا اجزایی که بیماری را ایجاد میکنند، میباشد. بدین ترتیب، توسعهٔ تصویربرداری مولکولی را میتوان به عنوان مکمل روشهای تصویربرداری تثبیت شدهٔ موجود به جای جایگزینی بالقوه برای آنها در نظر گرفت.
- هر یک از مدالیتهها مزایا و معایبی دارند. برای مثال، روشهای هستهای حساسیت بالایی دارند اما رزولوشن مکانی آنها پایین است و توصیف ضعیفی از آناتومی ارائه میدهند. در مقابل، MRI رزولوشن مکانی خوبی دارد، در حالی که حساسیت آن پایین است، هر چند این امر میتواند با استفاده از عوامل کنتراست با زمان استراحت بالا (relaxivity) بهبود یابد. در نهایت، فرآیند خاص مولکولی که به عنوان هدف انتخاب شده است، تکنیک مورد نظر را تعیین میکند. با این حال، در میان روشهای موجود، MRI به تنهایی مزایای رزولوشن مکانی بالا را با توانایی استخراج اطلاعات فیزیولوژیکی و آناتومیکی ترکیب میکند، به همین دلیل تلاشهای بسیاری برای یافتن راه حلهای که قادر به بهبود پاسخ پروبها (از نظر حساسیت) باشند، انجام گرفتهاست تا نقش MRI را در زمینه کاربردهای تصویربرداری مولکولی افزایش دهد.
ترکیب تصویربرداری مولکولی و MRI
- همان طور که قبلاً اشاره شد، در مقایسه با سایر روشهای تصویربرداری، مزیت اصلی تصویر برداری تشدید مغناطیسی (MRI) رزولوشن مکانی بسیار بالای آن است، در حالی که اشکال اصلی آن محدود بودن میزان حساسیت (sensitivity) پروبهایش میباشد.
- تصویربرداری تشدید مغناطیسی از طیف قابل توجهی از خواص فیزیکی و شیمیایی پروتونهای آب (یعنی هستههای هیدروژن) استفاده میکند و به عنوان یکی از روشهای تصویربرداری غیرتهاجمی برجسته شناخته شدهاست. سیگنالی که در MRI آشکارسازی میشود، از طریق تعامل مجموع سیگنال آب (چگالی پروتون) و خواص مغناطیسی بافتهایی که تصویربرداری میشوند، بدست میآید. منظور از این خواص مغناطیسی، زمان استراحت طولی T1 و زمان استراحت عرضی T2 میباشد. معکوس این مقادیر به ترتیب نرخ استراحت طولی R1 و عرضی R2 را نشان میدهد. سیگنال با افزایش R1 تمایل به افزایش دارد و با افزایش R2 کاهش مییابد. زمانهای استراحت طولی و عرضی پروتون وابسته به محیط فیزیکی و شیمیایی بافت مورد نظر است و در حضور یک حالت پاتولوژیکی تغییر مییابند. از این رو، MRI تمایز بین بافتهای مختلف در بدن و هم چنین بین بافتهای نرمال و آسیب دیده را امکان پذیر میکند.
- از آنجا که عوامل عمده و تعیینکنندهٔ کنتراست در تصاویر 1H-MR زمانهای استراحت (T1 و T2) پروتونهای بافت هستند، جستجوی مواد پارامغناطیس به عنوان مواد شیمیایی که بتوانند به صورت ماده کنتراست زا در نواحی که توزیع میشوند، ایدهٔ منطقی به نظر میرسد.
- در سال ۱۹۷۹، Lauterbur نشان داد که حضور یونهای پارامغناطیس منگنز (II) نرخ استراحت پروتونها را در منطقهٔ دچار انفارکتوس شدهٔ قلب سگ به میزان چشمگیری افزایش میدهد. دو سال بعد Weinmann و همکارانش دربارهٔ تأثیر Gd-DTPA بر روی تصاویر تشدید مغناطیسی در انسانها گزارشی ارائه دادند، در نتیجه مسیری برای استفاده از مادهٔ حاجب در محیطهای کلینیکی ایجاد شد. به زودی مشخص شد که اتصال یک کمپلکس پارامغناطیس به لایه¬هایی که به آرامی حرکت میکنند میتواند منجر به افزایش قابل ملاحظهٔ زمانهای استراحت پروتونهای محلول در آب در اسکنرهای ۵/۰-۵/۱ تسلا شود.
بهطور کلی مواد حاجب (عوامل کنتراست برونی) در MRI در دو دستهٔ اصلی زیر قرار میگیرند:
- کمپلکسهای پارامغناطیس (Paramagnetic Complexes)
- ذرات فوق پارامغناطیس اکسید آهن (Super paramagnetic iron oxide particles)
- کمپلکسهای پارامغناطیسس یونهای فلزی با حالتهای پایه الکترونیکی متقارن مانند (Gd (III و (Mn (II بهطور موفقیت آمیزی به عنوان ماده حاجب در MRI تا اواخر دهه ۱۹۸۰ به کار گرفته شدهاند. توانایی برجسته آنها در کوتاه کردن زمان استراحت طولی (T1) پروتونهای آب از طریق تعامل با الکترونهای جفت نشدهٔ یونهای فلزی است. تا زمانی که استفاده از این مواد در تصویربرداری مولکولی مورد توجه است، مسئلهٔ اصلی به صورت حساسیت بالای لازم برای هدفهای بیولوژیکی که در غلظتهای بسیار کم حضور دارند، مطرح میشود. بنابراین، چالش اصلی در مورد این دسته از مواد برای سالهای آینده دست یافتن به بالاترین حساسیت ممکن است. بازده این شلاتههای فلزی برای کاتالیز کردن فرآیند استراحت پروتون آب معمولاً با توجه به نرخ استراحت طولی (r1) بیان میشود که میزان افزایش نرخ استراحت پروتون آب را در محلولهای حاوی ۱ میلی مولار املاح پارامغناطیس نشان میدهد.
- ذرات فوق پارامغناطیس اکسید آهن (SPIO) اغلب به عنوان پروبهای تصویربرداری MR برای آزمایشهای تصویربرداری مولکولی مورد استفاده قرار گرفتهاند. این ذرات میتوانند به نحو مؤثری T2 پروتونهای آب را کوتاه کنند. مکانیزم تولید کنتراست به خواص مغناطیسی ذراتی وابسته است که اثر تمایل (susceptibility) مغناطیسی قوی روی پروتونهای آب که در اطراف ذره پخش میشوند، القا میکند.
نحوه تأثیر عوامل ایجاد کنتراست روی تصاویر MRI
- مواد پارامغناطیس، R1 و R2 را به مقدار یکسان افزایش میدهند، اما درصد تغییرات R1 در یک بافت بسیار بیشتر از درصد تغییرات R2 در آن بافت است. به همین دلیل، در این حالت تصاویر T1-weighted رزولوشن خیلی خوبی خواهند داشت. در حالی که مواد حاجب فوق پارامغناطیس بهطور کلی منجر به افزایش بیشتری در R2 میشوند و با اسکنهای T2-weighted بسیار بهتر قابل مشاهده هستند.
- توانایی یک ماده حاجب برای افزایش R1 و R2 در هر میلی مولار محلول حاوی آن ماده حاجب به ترتیب به عنوان نرخ استراحت طولی و عرضی (r1 و r2) تعریف میشود و بر حسب mM/sec بیان میشود.
- مواد پارامغناطیس، بهطور مستقیم روی پروتونهای آب در همسایگی خیلی نزدیک خود اثر میگذارند، در نتیجه، تأثیر آنها به صورت محلی (local) بوده و به میزان زیادی به شار آب در محل مورد نظر بستگی دارند و بایستی بهطور مطلوبی در تماس با آب با شار مناسب قرار داشته باشند. در حالی که، مواد فوق پارامغناطیس روی میدان مغناطیسی، صرف نظر از محیط پیرامون آنها، اثر میگذارند، بنابراین تأثیرشان در رابطه با کنتراست محلی نیست. با این حال، مواد حاجب MRI به دلیل کم بودن اختصاصی بودن شان (specificity) محدود میشوند.
- برای مثال، ماده حاجب gadolinium به غلظت بافت از مرتبه 7-10 مول بر گرم نیاز دارد تا کنتراست مناسبی در تصویر نهایی ایجاد کند. این میزان برای بیومارکرهای مولکولی اسپارس که در بدن موجودات زنده وجود دارند، بسیار بزرگ است، زیرا گیرندههای معمول غالباً در غلظتهای 13-10 تا 9-10 مول بر گرم حضور دارند. بنابراین، یک راه حل تقویتکننده برای غلبه بر این مسئله حساسیت نیاز است که استفاده از نانوذرات ایده مناسبی است.
استفاده از نانوذرات در تصویربرداری مولکولی
- نانوذرات در واقع گروههای کوچکی از اتمها هستند که قطر آنها تقریباً ۱۰ تا ۱۰۰ نانومتر است و امکان بهبود انتقال دارو را علاوه بر کاربرد به عنوان ماده حاجب هدفمند فراهم میکنند. در این صورت، مقدار زیادی از ماده حاجب میتواند در یک ذرهٔ تنها جا داده شود، بدین ترتیب، میزان relaxivity مؤثر هر ذره افزایش مییابد و در نتیجه، سیگنال مطلوب برای تصویربرداری افزایش مییابد.
نانوذرات باید دارای ویژگیهای خاصی باشند تا بتوانند تصویربرداری مولکولی را تسهیل کنند:
- نیمه عمر انتشار آنها باید از مرتبه ساعت باشد تا امکان exposure کافی و تعامل با مکان بیومارکر سلولی را فراهم کند.
- میزان سمی بودن آنها باید در محدوده مجاز باشد.
- باید بهطور خاص با ناحیه انتخاب شده برایشان ترکیب شوند.
- برای موارد کلینیکی مناسب باشند.
- مشکلی که در استفاده از این نانوذرات وجود دارد، کاهش میزان اختصاصی بودن (specificity) به دلیل بزرگ بودن این ذرات است. در نتیجه، راه حلی که به دنبال رفع این مشکل مطرح گردید، افزایش پولاریزاسیون (Hyperpolarization) ماده حاجب خارج از اسکنر و سپس تزریق آن به ناحیه مورد نظر بدن بیمار و در نهایت گرفتن تصویر از بیمار توسط اسکنر MRI است.
Hyperpolarization، راه حل محتمل برای افزایش سیگنال در MRI
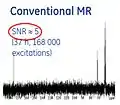
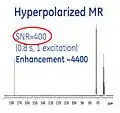
- منظور از Hyperpolarization، فعال کردن عامل کنتراست قبل از تزریق آن به بیمار است. از این طریق میتوان سیگنال NMR را تا تقریباً۱۰۰٫۰۰۰ برابر در یک اسکنر MRI، سه تسلا افزایش داد. بدین ترتیب، نسبت سیگنال به نویز (SNR) به شدت بهبود مییابد.
- هستههای بسیاری میتوانند به عنوان پروبهای مولکولی برای تصویربرداری تشدید مغناطیسی پلاریزه به کار روند. از جمله این اتمها میتوان به 19F، 3He و 13C اشاره کرد.
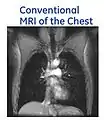
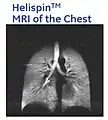
- با استفاده از گاز 3He هایپر پولاریزه شده در تصویربرداری MRI از ریهها، تصاویری ایجاد میشود که هرگز با روش MRI معمول نمیتوان به چنین تصاویری دست یافت. در MRI معمول، منبع سیگنال MR پروتونهای آب میباشد، همانطور که ملاحظه میشود بافت ریه در این حالت قابل مشاهده نیست. در حالی که در Hyperpolarized MRI، منبع سیگنال MR گاز 3Heاست که در آن عمده مسیرها و فضای هوایی قابل مشاهده است.
محدودیتهای استفاده از گازهای Hyperpolarized
- به صورت گسترده کاربرد ندارند.
- در حال حاضر در بسیاری از موارد تنها به گازهای نجیب محدود میشود.
- هنگامی که هایپر پولاریزه می¬شوند، ترکیب آن¬ها مشکل خواهد بود و بعد از در هم آمیخته شدن هم هایپرپلاریزه کردن شان تقریباً غیرممکن است.
- هنگامی که هایپرپولاریزه میشوند، نیمه عمر کوتاهی دارند و باید در محفظههای مخصوصی ذخیره و منتقل شوند. در حال حاضر، محفظههای جدید، امکان نگهداری مواد هایپرپولاریزه شده را تا حدود ۱۰۰ ساعت فراهم میکنند.
- از این رو، استفاده از 13C Hyperpolarization در سالهای اخیر مطرح شدهاست که مزایای آن علاوه بر استفاده در مطالعات روی بافت ریه، شامل آنژیوگرافی و تصویربرداری عملکردی مولکولی حقیقی از سیستمهای مختلف میشود. این ماده میتواند با مواد شیمیایی آلی مختلفی از جمله پیروات سدیم (sodium pyruvate)، سدیم استات(sodium acetate) و سدیم بیکربنات (sodium bicarbonate) ترکیب شود. هم چنین، محققان میتوانند 13C را هنگامی که با مواد خاصی مزدوج شده است، هایپرپولاریزه کنند.
مزایای استفاده از 13C MR
- 13C ایزوتوپ پایدار (غیر تشعشعکننده) کربن است و از لحاظ مغناطیسی نیز فعال میباشد.
- فرکانس سیگنال آن برای محیطهای شیمیایی خاص، متفاوت است و میتواند برای شناسایی اجزای محیط به کار رود.
- وقتی برای یک مکان مشخص نشانگذاری شود، دارای طول عمر به اندازه¬ی کافی بزرگ است.
- در غلظتهای میلی مولار، برای اسپکتروسکوپی MR مناسب است.
- همان طور که می دانیم امروزه میتوان تصویر سه بعدی از آناتومی کل بدن را در چند ثانیه با استفاده از 1H-MRI بدست آورد. بنابراین انتظار میرود در آیندهای نه چندان دور، با ترکیب MRI و Hyperpolarized 13C، دست یافتن به اطلاعاتی درباره فرآیند بیماری در سطح سلولی امکان پذیر شده و روشهای تشخیص و درمان بهبود یابد.
منابع
- Enzo Terreno, Daniela Delli Castelli, Alessandra Viale, and Silvio Aime, “Challenges for Molecular Magnetic Resonance Imaging”, Department of Chemistry IFM and Molecular Imaging Center, University of Torino, Torino, Italy, American Chemical Society, Chem Rev. 2010, No 110, pp. 3019–3042, 2010.
- John C. Gore, H. Charles Manning, C. Chad Quarles, Kevin W. Waddell, Thomas E. Yankeelov, " Magnetic resonance in the era of molecular imaging of cancer", Magnetic Resonance Imaging, No 29, 587 – 600, 2011.
- Tarik F. Massoud and Sanjiv S. Gambhir, " Molecular imaging in living subjects: seeing fundamental biological processes in a new light", Cold Spring Harbor Laboratory Press, 545-580, 2012.
- Dorota Kozlowska, Paul Foran, Peter MacMahon, Martin J. Shelly, Stephen Eustace, Richard O'Kennedy, "Molecular and magnetic resonance imaging: The value of immunoliposomes", Advanced Drug Delivery Reviews, No 61, 1402–1411, 2009
.
پیوند به بیرون
| این نوشتار نیازمند پیوند میانزبانی است. در صورت وجود، با توجه به خودآموز ترجمه، میانویکی مناسب را به نوشتار بیفزایید. |
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.