ولتامتری چرخهای
ولتامتری چرخهای (به انگلیسی: Cyclic voltammetry) یکی از انواع روشهای اندازهگیری الکتروشیمیایی پتانسیودینامیک میباشد. در یک آزمایش ولتامتری چرخهای پتانسیل الکترود کارگر به صورت خطی با زمان تغییر میکند. بر خلاف ولتامتری روبش خطی، بعد از رسیدن به یک پتانسیل تعیین شده، پتانسیل الکترود کارگر در جهت عکس تغییر میکند تا به پتانسیل اولیه بازگردد. این چرخههای تغییر پتانسیل میتوانند به تعداد دلخواه تکرار شوند. جریان ایجاد شده در الکترود کارگر بر حسب ولتاژ (پتانسیل الکترود کارگر) رسم میشود تا نمودار ولتامتری چرخهای به دست آید. ولتامتری چرخهای معمولاً برای مطالعه یک نمونه در داخل محلول یا یک ماده آبکاری شده بر روی الکترود کارگر و همچنین برای سنتز الکتروشیمیایی مورد استفاده قرار میگیرد.[1][2][3]
روش تجربی
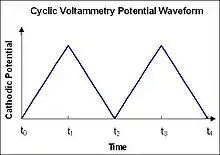
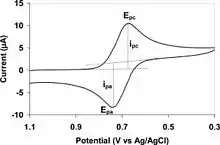
در ولتامتری چرخهای پتانسیل الکترود به صورت خطی بر حسب زمان در فازهای چرخهای تغییر میکند (شکل ۲). سرعت تغییر ولتاژ بر حسب زمان در طول هر یک از این فازها با عنوان سرعت روبش شناخته میشود. پتانسیل بین الکترود مرجع و الکترود کارگر اعمال میشود در حالیکه جریان بین الکترود کارگر و الکترود کمکی اندازهگیری میگردد. این دادهها به صورت جریان (i) در مقابل پتانسیل اعمال شده (E، اغلب فقط باعنوان 'پتانسیل') رسم میشوند. در شکل ۲ در طول روبش رفت اولیه (از t0 تا t1) بهطور فزایندهای پتانسیل کاهشی اعمال شدهاست؛ بنابراین با فرض وجود نمونه احیا شونده در سیستم، جریان کاتدی حداقل در مراحل اولیه در طول این دوره زمانی افزایش خواهد یافت. کمی بعد از رسیدن به پتانسیل احیای نمونه جریان کاتدی با کاهش غلظت ذرات احیا شونده کاهش خواهد یافت. اگر زوج ردوکس برگشتپذیر باشند در طی روبش برگشت (از t1 تا t2) نمونه احیا شده شروع به اکسایش محدد کرده و باعث ظهور یک جریان (جریان آندی) با قطبیت عکس نسبت به قبل (روبش رفت) میشود. هرچه مقدار ذرات جفت ردوکس برگشت پذبر بیشتر باشد شکل پیک اکسایش شباهت بیشتری به پیک احیا خواهد داشت؛ بنابراین دادههای ولتامتری چرخهای اطلاعاتی در مورد پتانسیلهای ردوکس و سرعتهای واکنش الکتروشیمیایی فراهم میکنند.
مثلاً اگر انتقال الکترون در سطح الکترود کارگر سریع باشد و جریان فقط با نفوذ ذرات نمونه به سمت سطح الکترود محدود شود، در این صورت جریان پیک با ریشه دوم سرعت روبش متناسب خواهد بود. این رابطه با معادله کاترل توصیف میشود. در این حالت، ولتامتری چرخهای تنها بخش کوچکی از محلول یعنی لایه نفوذ در سطح الکترود را مورد آزمایش قرار میدهد.
خصوصیات
سودمندی ولتامتری چرخهای به شدت وابسته به نمونه مورد مطالعه میباشد. نمونه باید زوج ردوکس الکتروفعال در محدوده روبش پتانسیل باشد.
زوج برگشتپذیر
اغلب نمونه یک موج ولتامتری چرخهای برگشتپذیر نشان میدهد که این حالت زمانی مشاهده میشود که تمام ذرات نمونه اولیه پس از یک روبش رفت و برگشت بازیابی شوند. اگرچه چنین زوجهای برگشتپذیری به آسانی تحلیل میشوند ولی حاوی اطلاعات کمتری نسبت به اشکال موج پیچیده میباشند.
تفاوت بین دو قله پتانسیل (E,p) یعنی ΔEpمورد توجه ویژه است:
ΔEp = |Epc - Epa|
این تفاوت بهطور عمده در نتیجه اثرات سرعت انتشار (نفوذ) نمونه است. در حالت ایدهآل برای یک زوج برگشتپذیر یک الکترونی مقدار ΔEp برابر با ۵۹mVاست. مقادیر معمولی که به صورت تجربی مشاهده شدهاند بیشتر بوده و اغلب نزدیک به ۷۰ یا ۸۰mV میباشند. شکل موج همچنین با سرعت انتقال الکترون که معمولاً با عنوان سد فعال سازی برای انتقال الکترون بحث میشود، متأثر میگردد. یک توصیف تئوری برای اضافه ولتاژ پلاریزاسیون با معادلات باتلر- ولمر و کاترل شرح داده میشود. برای یک سیستم ایدهآل این روابط برای یک فرایند n الکترونی به معادله میل میکنند.[2]
با تمرکز بر روی جریان زوجهای برگشتپذیر ایدهآل با رابطه ipa/ipc = ۱ مشخص میشوند
وقتی یک پیک برگشتپذیر مشاهده میشود، اطلاعات ترمودینامیکی به شکل یک پتانسیل نیم پیل E01/2 قابل تعیین خواهد بود. حتی هنگامی که امواج نیمه برگشتپذیر باشند(ipa/ipc نزدیک به یک است ولی نه برابر با آن) میتوان اطلاعات ویژه بیشتری نیز به دست آورد.
زوجهای برگشتناپذیر
بسیاری از فرایندهای اکسیداسیون و احیای مشاهده شده با ولتامتری چرخهای شبه برگشتپذیر یا برگشتناپذیر هستند. در چنین مواردی پتانسیل ترمودینامیکی E01/2 اغلب با شبیهسازی به دست میآید. برگشتناپذیری با ipa/ipc ≠ ۱ مشخص میشود. انحراف از مقدار ۱ به یک واکنش شیمیایی متعاقب که با انتقال الکترون راه اندازی مشود، نسبت داده شدهاست. چنین فرایندهای الکتروشیمیایی میتوانند پیچیده بوده و شامل ایزومریزه شدن، تفیکیک، تجمع و غیره باشند.[4]
راه اندازی آزمایشگاهی
آزمایش ولتامتری چرخهای با یک محلول که داخل یک سل مجهز به الکترود قرار گرفته هدایت میشود. این محلول شامل حلالی است که الکترولیت و اجزای مورد مطالعه را در خود حل نمودهاست.[5]
سل
یک آزمایش ولتامتری چرخهای استاندارد یک سل مجهز به سه الکترود را به کار میگیرد: الکترود مرجع، الکترود کارگر و الکترود کمکی (شمارنده). این ترکیب گاه با عنوان سیستم سه الکترودی یاد میشود. برای اطمینان از رسانایی کافی معمولاً به محلول نمونه الکترولیت اضافه میشود. حلال، الکترولیت و ترکیب مواد الکترود کارگر، محدوده پتانسیل قابل دسترس در طول آزمایش را تعیین خواهند نمود.
در طول ولتامتری چرخهای الکترودها بی حرکت بوده و در محلولی بدون همزن قرار میگیرند. این روش محلول راکد منجر به پیکهای مربوط به واکنش کنترل شده با نفوذ خواهد شد. این روش همچنین اجازه میدهد تا بخشی از نمونه پس از اکسایش و احیا باقی بماند طوری که ممکن است فعالیت ردوکس بیشتری نیز نشان دهد. به منظور فراهم کردن نمونه تازه در سطح الکترود برای هر آزمایش هم زدن محلول ما بین ترسیمهای ولتامتری چرخهای مهم میباشد. حلالیت یک نمونه میتواند با تغییر بار کلی آن به شدت تغییر کند؛ همچنین رسوب دهی گونه احیا یا اکسید شده بر روی الکترود متداول میباشد. این لایه نشانی گونه بر روی الکترود میتواند سطح الکترود را جدا کرده و فعالیت ردوکسی مربوط به خود را در روبشهای بعدی نشان دهد یا به طریق دیگر سطح الکترود را دگرگون کرده و بر روی آزمایش ولتامتری چرخهای تأثیر بگذارد. به همین دلیل معمولاً تمیز کردن الکترودها مابین روبشها ضروری میباشد.
مواد رایج به کار رفته برای الکترود کارگر شامل کربن گلاسه، پلاتین و طلا میباشد. این الکترودها معمولاً با یک ماده عایق روکش میشوند به طوری که خود الکترود به صورت یک دیسک در انتهای آن نمایان است. یک الکترود کارگر عادی شعاعی به درجه بزرگی یک میلیمتر دارد. داشتن یک مساحت کنترل شده با شکلی مشخص برای یک الکترود برای تفسیر درست نتایج ولتامتری چرخهای ضروری میباشد.
برای اجرای ولتامتری چرخهای در سرعتهای روبش بالا یک الکترود کارگر عادی مناسب نیست. سرعتهای روبش بالا پیکهایی با جریان بالا و مقاومت افزایش یافته تولید میکنند که منجر به انحراف از حالت عادی میشوند. اولترا میکرو الکترودها (UME) میتوانند برای کاهش جریان و مقاومت به کار برده شوند.
الکترود شمارنده که با عنوانهای کمکی یا دوم نیز شناخته میشود میتواند از هر مادهای که جریان را به خوبی هدایت کرده و خود وارد واکنش با توده محلول نگردد، ساخته شود. واکنشهای رخ داده در سطح الکترود کمکی تا زمانی که جریان را به خوبی هدایت کند مهم نخواهند بود.
حلالها
ولتامتری چرخهای میتواند با حلالهای مختلفی هدایت شود. با استفاده از الکترودهای معمول، حلالها نه تنها نمونه را اغلب در حد میلی مولار حل میکنند الکترولیت را نیز در غلظتهای بالا در خود حل میکنند. برای محلولهای آبی این ملزومات به راحتی به دست میآیند ولی برای محلولهای غیرآبی گزینههای مناسب به عنوان حلال کمتر هستند.[6]
الکترولیت
الکترولیت رسانایی الکتریکی خوب را تضمین نموده و افت iR را به حداقل میرساند به طوری که پتانسیل ثبت شده متناظر پتانسیل واقعی میباشد. برای محلولهای آبی الکترولیتهای فراوانی در دسترس هستند ولی الکترولیتهای معمول نمکهای فلزات قلیایی پرکلرات و نیترات میباشند. در حلالهای غیرآبی محدوده الکترولیتها بسیار محدودتر است و گزینه معمولتر تترابوتیل آمونیوم هگزافلوئورو فسفات (TBAF) میباشد.[7]
کاربردها
ولتامتری چرخهای تبدیل به یکی از مهمترین و پرکابردترین روشهای الکتروتجزیهای در بسیاری از حوزههای شیمی شدهاست. این روش اغلب برای مطالعه فرایندهای ردوکس مختلف، تعیین پایداری محصولات واکنش، حضور حد واسطها در واکنشهای ردوکس، سینتیک انتقال الکترون و برگشتپذیری یک واکنش استفاده میشود. این روش همچنین میتواند برای تعیین استوکیومتری الکترونی یک سیستم، ضریب نفوذ یک نمونه و پتانسیل احیای فرمال یک گونه به کار رود. علاوه بر آن، از آنجاییکه غلظت در یک سیستم نرستی برگشتپذیر متانسب با جریان است، غلظت یک محلول مجهول را میتوان با رسم بک منحنی کالیبراسیون از جریان بر حسب غلظت به دست آورد.[8]
در بیولوژی سلولی از این روش میتوان برای تعیین غلظت در بافتهای زنده استفاده نمود. در شیمی آلی- فلزی از این روش برای ارزیابی مکانیسمهای ردوکس استفاده میشود.[9]
از این تکنیک میتوان برای سنتز الکتروشیمیایی از جمله سنتز پلیمرهای رسانا بهره برد.[10]
منابع
- Bard, Allen J.; Larry R. Faulkner (2000-12-18). Electrochemical Methods: Fundamentals and Applications (2 ed.). Wiley. ISBN 0-471-04372-9.
- Nicholson, R. S.; Irving. Shain (1964-04-01). "Theory of Stationary Electrode Polarography. Single Scan and Cyclic Methods Applied to Reversible, Irreversible, and Kinetic Systems". Analytical Chemistry. 36 (4): 706–723. doi:10.1021/ac60210a007.
|access-date=requires|url=(help) - Heinze, Jurgen (1984). "Cyclic Voltammetry-"Electrochemical Spectroscopy". New Analytical Methods (25)". Angewandte Chemie International Edition in English. 23 (11): 831–847. doi:10.1002/anie.198408313.
|access-date=requires|url=(help) - http://www.currentseparations.com/issues/18-1/cs18-1b.pdf
- Faulkner, L. R. , "Understanding electrochemistry: Some distinctive concepts", Journal of Chemical Education 1983, 60, 262. doi:10.1021/ed060p262
- Kosuke Izutsu "Electrochemistry in Nonaqueous Solutions" Second Edition Wiley-VCH, Weinheim. 2009.
- Geiger, W. E. ; Barriere, F. , "Organometallic Electrochemistry Based on Electrolytes Containing Weakly-Coordinating Fluoroarylborate Anions", Accounts of Chemical Research 2010, volume 43, pp. 1030-1039. doi:10.1021/ar1000023
- Carriedo, Gabino (1988). "The use of cyclic voltammetry in the study of the chemistry of metal carbonyls". J.Chem.Educ. 65: 1020. doi:10.1021/ed065p1020.
- Geiger, W. E. , "Reflections on Future Directions in Organometallic Electrochemistry", Organometallics 2011, volume 30, pp. 28-31. doi:10.1021/om1010758
- «Investigation of anomalous diffusion and multifractal dimensions in polypyrrole film». Journal of Electroanalytical Chemistry. Elsevier. ۲۰۱۲. doi:10.1016/j.jelechem.2012.02.014.