واکنش خودکاتالیزی
یک واکنش شیمیایی را واکنش خودکاتالیزی میگویند اگر یکی از محصولات واکنش خود یک فروکافت برای همان واکنش یا یک واکنش جفت باشد.[1]
یک مجموعه واکنش را زمانی میگوییم با هم خودکاتالیز اند که اگر شماری از آن واکنشها محصولی تولید کنند که برای شماری دیگر از واکنشها فروکافت باشد.
اگر سادهترین واکنش خودکاتالیزی را به صورت زیر بنویسیم:
و معادله سرعت را برای یک واکنش اولیه به صورت زیر بنویسیم:
- .
در این واکنش مولکولهای گروه A با مولکولهای نوع B اندرکنش دارد مولکول نوع A به نوع B تبدیل میشود و محصول نهایی شامل مولکولهای نوع B اولیه و مولکولهای نوع B تولیدی در طی واکنش است. نکتهٔ این واکنش این است که معادلات سرعت از سامانه غیرخطی پیروی میکنند. عبارت دوم در سمت راست با توان ۲ غلظت B تغییر میکند.
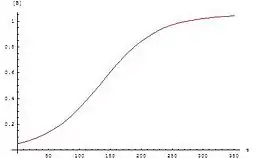
غلظت A و B بر حسب زمان به صورت زیر تغییر میکند:[1][2]
و
- .
منحنی این معادلات به صورت تابع سیگموئید است که برای واکنشهای خودکاتالیزی بسیار معمول است. چنین واکنشهایی در آغاز بسیار کند اند چون کاتالیزگر کمی وجود دارد اما با افزایش فروکافت، سرعت واکنش نیز افزایش مییابد اما در نهایت دوباره سرعتش کم میشود چون غلظت واکنش دهندهها کم شدهاست.
اگر منحنی غلظت واکنش دهندهها یا محصولات از تابع سیگموئید پیروی کند آن واکنش میتواند یک واکنش خودکاتالیزی باشد.
چنین معادلههای سینماتیکی میتوانند برای هیدرولیز کاتالیزی اسید برخی استرها به کربوکسیلیک اسیدها و الکلها کاربرد دارند.[2] برای آغاز یک سازوکار کاتالیزی نیاز به دست کم یک اسید است. اگر چنین نیست واکنش باید از طریق روشهای جایگزین بدون کاتالیزگر آغاز شود که معمولاً آهستهتر است. معادلات بالا برای سازوکار کاتالیزگر نشان میدهد که غلظت محصول اسیدی در نهایت صفر میماند.[2]