نظریه حالت گذار
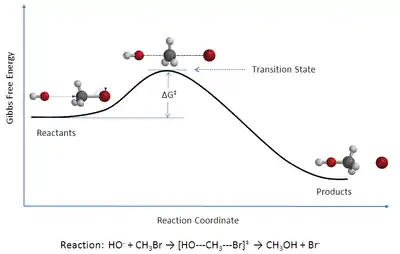
نظریه حالت گذار(به انگلیسی: Transition state theory) نظریه ای در سینتیک شیمیایی است که چگونگی انجام یک واکنش شیمیایی بین مواد واکنش دهنده و تولید فرآورده را توصیف میکند.در این نظریه مفهومی فرضی به نام حد واسط یا کمپلکس فعال معرفی میشود که عبارت است از ماده ای با سطح انرژی بالا که در آن پیوند های مواد واکنش دهنده در حال سست شدن و پیوندهای مواد فراورده در حال تشکیل است.با استفاده از نمودار مربوط به این تئوری میتوان مقدار انرژی فعال سازی واکنش، آنتالپی واکنش و نوع واکنش(گرما گیر یا گرماده بودن)را تشخیص داد.[1] این نظریه توسط احمدزویل شیمیدان مسلمان مصری در سال1999 عنوان شد که به این علت موفق به دریافت جایزه نوبل شیمی گردید.در این نظریه برخی از نارساییهای نظریه "برخورد" برطرف شده از جمله اینکه این نظریه افزون برفاز گازی برای فاز محلول نیز قابل استفاده است. در این نظریه هنگام برخورد واکنش دهندهها مولکولها مدت زمانی کنار هم قرار میگیرند در این حالت پیوندهای اولیه سست شده و پیوندهای تازه تشکیل میشوند.به حالتی که در آن همزمان پیوند اولیه در حال شکستن و پیوند جدید در حال تشکیل است که به این حالت،حالت گذار یا پیچیده فعال میگویند. پیچیده فعال ذره بسیار ناپایداری است که در حین واکنش نمیتوان آن را جداسازی و شناسایی کرد. نخستین بار احمد زویل ادعا کرد ک عمر پیچیده فعال در حدود یک فمتو ثانیه است. در نظریه گذار سرعت واکنش با انرژی فعالسازی واکنش رابطه عکس دارد.
منابع
- مورتیمر، چارلز (۱۳۸۳). شیمی عمومی ۱. اول. تهران: نشر علوم دانشگاهی. ص. ۲۳۴. شابک ۹۶۴۶۱۸۶۳۳۵.