سامانه حسی-پیکری
سامانه حسی-پیکری (به انگلیسی: Somatosensory System) (یا دستگاه حسی-پیکری) بخشی از دستگاه حسی است. دستگاه حسی-پیکری مجموعه پیچیده ای از نورون های حسی و مسیرهای عصبی است که به تغییرات در سطح یا داخل بدن واکنش نشان می دهند. آکسونهای (به عنوان الیاف عصبی آوران) نورونهای حسی به سلول های گیرنده مختلفی متصل شده یا به آن ها پاسخ می دهند. این سلولهای گیرنده حسی توسط تحریکات مختلفی چون گرما و درد فعال شده و به همین دلیل نام این نورون ها مربوط به نوع واکنشی است که از خود بروز می دهند. مثلاً گیرنده گرمایی اطلاعات تغییر دما را منتقل می کند. انواع دیگر شامل گیرنده مکانیکی، گیرنده شیمیایی و گیرنده درد است که پیام هایشان را از طریق عصب حسی به طناب نخاعی رسانده، جایی که این اطلاعات ممکن است با نورونهای حسی دیگر پردازش شده و در نهایت برای پردازش بیشتر به مغز بازارسال (رله) شوند. گیرندههای حسی در تمام بدن شامل پوست، بافت پوششی، ماهیچه اسکلتی، استخوانها، مفاصل، اعضای داخلی و دستگاه گردشی یافت می شوند.

حسهای پیکری را برخی مواقع حسهای سومستتیک (به انگلیسی: Somesthetic Senses)،[1] می نامند، با این نیت که احساسات سومستتیک شامل حس لامسه، حس عمقی (حس موقعیت و حرکت)، و (بسته به کاربرد) حس هپتیک.[2]
نگاشت سطوح بدن در مغز را بدن-نگاری (سوماتوتوپی) می نامند. در قشر مغز به این نگاشت، هومونکولوس قشری (یا انسان مینیاتوری قشری) می گویند. در هر صورت، نقشه سطح مغزی ("قشری") تغییرناپذیر نیست. براثر سکته یا جراحت ممکن است تغییرات شدیدی در این نگاشت شکل گیرد.
دستگاه حسی-پیکری
توسط دستگاه حسی-پیکری، نه فقط حس لامسه پوست، بلکه احساسات دیگری مانند زانو درد، تماس آلرژیک، فشار روده و گرفتگی گلو نیز به مخ مخابره می شوندد. این دستگاه بخشی از دستگاه اعصاب حسی است. این بخش یک سیستم پیچیده از سلول های عصبی حساس و مسیرهایی از آنها به سلولهای گیرندههای مختلف بوده که به تغییرات در سطح یا درون بدن پاسخ میدهند. بهطوری که سلولهای گیرندهٔ حسی با محرکهای مختلفی نظیر گرما فعال شده و یک پیام عملکردی برای نورونهای حسی این بخش میفرستند.
گیرندههای حسی-پیکری در سراسر بدن از جمله پوست، بافتهای پوششی غدد و عروق، ماهیچهها، استخوانها و مفاصل، اندامهای داخلی و سیستم قلبی عروقی یافت میشوند. میتوان شامل حس لامسه و ادراک مربوط به آن، حس خودآموزی (درک موقعیت مکانی و حرکت) و… باشد.[3]
تصویربرداری از سطوح بدن و موقعیت گیرندههای حسی در بخشهای مختلف آن و همچنین منطقه مربوط از قشر مغزی که توسط آن فعال شده تنجانمایی نامیده میشود. این نوع نقشه از مغز، تغییرناپذیر نیست؛ بهطوری که در پاسخ به مواردی همچون سکته یا آسیب مغزی تغییرات چشمگیری در آن رخ میدهد.
بررسی اجمالی دستگاه
حسگرهای مکانیکی
چهار حسگر مکانیکی در پوست هر یک به محرکهای مختلف به شکل کوتاهمدت و بلندمدت پاسخ میدهند.
انتهای عصب سلولی مرکل در روپوست پایهای پوست و فولیکولهای مو یافت میشود؛ اما اغلب به دلیل دارا بودن گیرندههای کوچک (توانایی ایجاد اطلاعات بسیار دقیق) در مناطقی مانند نوک انگشتان مورد استفاده بوده و به ارتعاشات کم (۵ تا ۱۵ هرتز) واکنش نشان میدهند. بهطور کلی آنها پوشش ندارند و در پاسخ به فشار خارجی آهسته عمل میکنند از اینرو تنها به محرکهای طولانی مدت پاسخ میدهند.
عروق خونی به ارتعاشات متوسط (۱۰ تا ۵۰ هرتز) و برخورد نور واکنش نشان میدهند. آنها در پاپیلهای پوست قرار داشته و به دلیل واکنشپذیری بالا عمدتاً در نوک انگشتان و لبها قرار دارند. بر خلاف مرکل، پاسخ آنها به محرکهایشان در قالب پتانسیلهای عمل سریع است. آنها مسئول توانایی خواندن خط بریل و محرکهای احساسی مثبت هستند.
ذرات لاملار بساوش اجسام بزرگ و تشخیص نرمی و سختی اجسام را بر عهده دارند. این گلبولها حساسترین حسگرهای مکانیکی نسبت به ارتعاشات میباشند؛ بهطوری که به ارتعاشات حدود ۲۵۰ هرتز واکنش داده و در ایجاد پتانسیل عمل و پاسخدهی، سریع عمل میکنند. البته این حسگرها فقط به محرکهای ناگهانی واکنش نشان داده و محرکهای طولانی مدت را به سرعت نادیده میگیرند.
ذرات بالبوس به آرامی واکنش نشان میدهند. آنها مسئول پاسخ به کشش پوست و تشخیص لغزش در یک جسم بوده و نقش مهمی در کنترل موقعیت و حرکت انگشتان دارند. بهطور کلی تمام این گیرندهها تحت فشارهایی قرار میگیرند که شکل آنها را پدیدآورده و موجب ایجاد پتانسیل عمل در آنها خواهد شد.[4][5][6][7][8][9][10]
حسگرهای عصبی
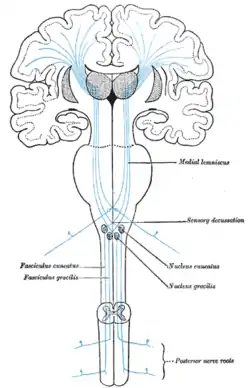
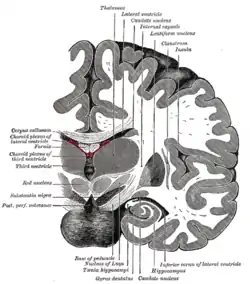
اطلاعات مربوط به بساوایی یا ارتعاش بهوسیلهٔ نخاع از طریق مسیر لنزوسوس در ستون فقرات از طریق Gracilis (مهره T7 و پایین آن) یا کونئاتوس (مهره T6 و بالای آن) به بالا میرود. کونئاتوس بهطور غیرمستقیم از طریق مایع خاکستری نخاعی سیگنالهایی را به هستههای cochlear ارسال میکند و این اطلاعات در تعیین اینکه آیا صدای درک شده سروصدا یا تحریک است استفاده میشود. همه این الیاف از medulla عبور میکنند.
زنجیرههای postcentral شامل قشر حسیتنی اولیه (مناطق برادمن ۳، ۲ و ۱) بهطور کلی به عنوان S1 شناخته میشوند.
BA3 متراکمترین افکشنها را از تالاموس دریافت میکند. BA3a با توجه به موقعیت نسبی قسمتهای بدن و مقدار تلاش در هنگام حرکت استفاده میشود و BA3b مسئول توزیع اطلاعات پیکری است، بهطوری که اطلاعات بافت را به BA1 و اطلاعات شکل و اندازه را به BA2 میدهد.
ناحیه S2 (قشر سوماتوسنسوری ثانویه) به منطقه S2 و منطقه parietal ventral تقسیم میشود. منطقه S2 با درک لمسی خاصی مشغول به کار است و به همین ترتیب با آمیگدال و هیپوکامپ ارتباط دارد تا خاطرات را تقویت کند. منطقه parietal ventral تقویتکننده سوماتوسنسوری به قشر premotor و قطب حافظه سوماتوسنسوری است.
BA5 یک توپوگرافی سازمانیافته برای حافظه پیکری و مناطق تجمع آن است. BA1 اطلاعات بافت را پردازش میکند در حالی که BA2 اطلاعات اندازه و شکل را پردازش میکند. منطقه S2 لمسهای سبک، درد، حسهای ذرهای و لمسهای متمرکز را پردازش میکند. S1 اطلاعات باقیمانده را پردازش میکند (لمس خام، درد، درجه حرارت).[11][12][13]
BA7 اطلاعات بصری و حس عمقی را برای قرار دادن اشیاء در فضا ادغام میکند.[14][15]
قشر منزوی (insula) نقش خود را در حس مالکیت بدنی، خودآگاهی ذهنی و ادراک ایفا میکند. همچنین در انتقال اطلاعات در مورد لمس احساسات، درد، درجه حرارت، خارش، و وضعیت اکسیژن محلی نقش دارد.
ساختار سیستم
سیستم سموتوسنسوری در تمام قسمتهای اصلی بدن مهرهداران گسترش مییابد. این سیستم شامل هر دو گیرندههای حساس و نورونهای عصبی در محدوده پوست، عضلات و اندام، به نورونهای عمیقتر در سیستم عصبی مرکزی است.
مسیر عمومی سوماتوسنسوری
یک مسیر حسی-پیکری بهطور معمول دارای سه نورون طولانی است:[16]
- نورون اول همیشه دارای سلولهایی در گانگلیون ریشه پشتی عصب ستون فقرات خواهد بود.
- نورون دوم دارای سلولهایی در نخاع یا در مغز است. این آکسونهای صعودی عضلانی به سمت مخالف یا در نخاع یا در مغز متصل میشوند.
- در مورد لامسه و نوع خاصی از درد، نورون سوم دارای سلولهایی در VPN تالاموس است و پایانههای آن در چینخوردگیهای postcentral مغز در لوب آهیانهای میرسد.

گیرندههای نوری، شبیه به آنچه در شبکیه چشم یافت میشود، بهطور خاص اشعه ماوراء بنفش را که موجب افزایش تولید ملانین توسط ملانوسیتها میشود تشخیص میدهد.[17] بنابراین برنزه شدن بهطور بالقوه پوست را از آسیب DNA و آفتاب سوختگی ناشی از اشعه ماوراء بنفش محافظت میکند. با این حال، این که این امر همچنان در دست تحقیق و بررسی است.[17]
بازخورد لمسی
بازخورد لمسی از گیرنده حس عمقی در پوست، ماهیچهها و مفاصل حاصل میشود.[18]
تعادل
گیرنده حس تعادل در سیستم ویستیبولار در گوش (برای تشخیص جهت سه بعدی سر و سپس بقیه بدن با استنباط از آن) قرار دارد. تعادل نیز توسط رفلکس زیباییشناسی تغذیه شده که موقعیت نسبی بقیه بدن را نسبت به سر حس میکند[19] علاوه بر این، حس عمقی تخمین محل اشیایی که توسط سیستم بصری شناسایی میشوند را به عنوان ورودی به رفلکسهای مکانیکی بدن بر عهده دارد.
لمس خوب و لمس خام
لمس خوب یک حالت حسی است که به یک فرد امکان میدهد تا یک لمس را با محلیسازی صحیح به خوبی حس کند. مسیر لنزیکس ستون مهرهای خلفی مسیری است که مسئول ارسال اطلاعات لمسی خوب به مغز است. شکل لمسی که در آن محلیسازی امکانپذیر نیست، به عنوان لمس خام شناخته میشود که الیاف آن مخالف با لمس خوب است و در بخش اسپیناتالامیک در ستون مهره پشتی حمل میشود.[20]
پردازش عصبی از بساوایی
قشر حسی-پیکری اطلاعات حسی ورودی را از گیرندهها در سراسر بدن کپی میکند. لمس مؤثر، نوعی از اطلاعات حسی است که موجب واکنش احساسی میشود مانند یک تماس فیزیکی انسان. این نوع اطلاعات در واقع متفاوت از سایر اطلاعات حسی است. شدت لمس عاطفی به شیوهای مشابه با احساسات ناشی از بینایی و شنوایی، همچنان در قشر سوماتوسنسوری اولیه کدگذاری میشود. همانند افزایش آدرنالین ناشی از لمس اجتماعی یک دوست خوب.
در همین حال، احساس لذت بخش در ارتباط با لمس عاطفی، قشر cingulateقدامی را بیشتر از قشر سوماتوسنسوری اولیه فعال میکند. دادههای fMRI نشان میدهد که سیگنال کنتراست سطح اکسیژن خون (BOLD) درون قشر کورتکس قدامی و قشر prefrontal همبستگی خوبی با یک لمس عاطفی دارد. تحریک مغناطیسی مغزی (TMS) قشر سوماتوسنسوری مغز، میزان ادراک از شدت لمس عاطفی را مهار میکند، اما دلپذیر بودن لمس عاطفی همچنان باقیست؛ بنابراین، S1 بهطور مستقیم در پردازش دلپذیری از لمس اجتماعی عاطفی دخالت نمیکند، اما همچنان نقش مهمی در تشخیص مکان و شدت لمس دارد.[20]
تنوع فردی
مطالعات گوناگونی نشان دادهاست که علت تفاوت بین افراد مختلف در حس آنها از یک لمس خوب است. یک ناحیه مورد مطالعه، هوش فضایی یک لمس صحیح است، یعنی توانایی فهمیدن جزئیات دقیق فضایی یک جسم که بهطور ثابت در برخورد با پوست قرار دارد. روشهای مختلفی برای سنجش هوش فضایی یک لمس صحیح استفاده شدهاست، شاید دقیقترین آنها آزمایش grating orientation است.[21] در این آزمایش افراد، جهتگیری یک سطح جارو مانند را در دو جهت مختلف تعیین میکنند[22] که میتواند به صورت دستی یا خودکار انجام شود.[23] بسیاری از مطالعات نشان میدهد که هوش فضایی لمس صحیح با افزایش سن کاهش مییابد؛[24][25][26] دلایل این کاهش ناشناخته است، اما ممکن است علت آن از دست دادن طبیعی گیرندههای لمسی در طول زمان باشد. بهطور قابل ملاحظهای، هوش فضایی لمس صحیح انگشتان در میان بزرگسالانی با نوک انگشتان کوچکتر بهتر است؛[27] این اثر مربوط به اندازه انگشتان، بهطور متوسط مبنای بهتر بودن این هوش فضایی در زنان نسبت به مردان است[27] و دلیل آن تراکم بیشتر گیرندههای مکانیکی لمسی است که موجب تشخیص بهتر ارتعاشات با فرکانس پایین در انگشتان کوچکتر میشود؛[28] این امر در بین کودکان از همان سن کودکی دیده میشود، بدین صورت که کودکان با انگشتان کوچکتر تمایل بیشتری به لمس اجسام دارند.[29] بسیاری از مطالعات نشان دادهاند هوش فضایی لمس صحیح در میان افراد نابینا نسبت به افراد سالم در همسن با آنها بیشتر است.[26][30][31][32][33] و این امر احتمالاً به علت cross modal plasticity درون قشر مغزی فرد نابینا میباشد؛ همچنین شاید به علت cortical plasticity باشد. گزارش شدهاست افرادی که از زمان تولد نابینا بودهاند اطلاعات لمسی را سریعتر از افراد سالم دریافت میکنند.[34]
اهمیت بالینی
کمبود سوماتوسنسوری ممکن است ناشی از نوروپاتی محیطی باشد که ناشی از کمبود تعداد اعصاب محیطی سیستم سوماتوسنسوری است. این امر ممکن است به عنوان بیحسی شناخته شود.
پیشرفت جامعه
تکنولوژی Haptic میتواند حس لامسه را در محیطهای مجازی و واقعی ایجاد کند.[35] این تکنولوژی میتواند در زمینه گفتار درمانی و بازخورد لمسی نیز برای درمان اختلالات گفتاری استفاده شود.
| حواس پنجگانه |
|---|
منابع
- O. Franzen, R. Johansson, L. Terenius (1996) Somesthesis and the Neurobiology of the Somatosensory Cortex
- Robles-De-La-Torre G (2006). "The Importance of the Sense of Touch in Virtual and Real Environments" (PDF). IEEE Multimedia. 13 (3): 24–30. doi:10.1109/MMUL.2006.69. S2CID 16153497. Archived from the original (PDF) on 24 January 2014. Retrieved 28 February 2021.
- Robles-De-La-Torre, G (2006). "The Importance of the Sense of Touch in Virtual and Real Environments". IEEE Multimedia. ۱3 (3): 24-30. doi:10.1109/MMUL.2006.69.
- Tillotson, Joanne; McCann, Stephanie (Apr 02, 2013). Kaplan’s Medical Flashcards. Check date values in:
|سال=(help) - Albertine, Kurt. Barron’s Anatomy Flash Cards.
- Sense of Touch - How Do We Feel? A Simple Explanation. HubPages. Jul 19, 2014. Web. 27 Mar, 2016. Check date values in:
|سال=(help) - Paré, Michel; Behets, Catherine (Wiley Online Library. 10 Feb, 2003. Web. 27 Mar, 2016). Paucity of Presumptive Ruffini Corpuscles in the Index Finger Pad of Humans. Check date values in:
|سال=(help) - Scheibert, J; Leurent, S; Prevost, A (2006). "The role of fingerprints in the coding of tactile information probed with a biomimetic sensor". Science. 323 (5920): 1503-6. doi:10.1126/science.1166467.
- Biswas, A; Manivannan, M; Srinivasan, MA (2015). "Vibrotactile sensitivity threshold: nonlinear stochastic mechanotransduction model of the Pacinian Corpuscle". IEEE Transactions on Haptics. 8 (1): 102-13. doi:10.1109/TOH.2014.2369422.
- Paré, Michel; Elde, Robert (JNeurosci. 15 Sept, 2001. Web. 27 Mar, 2016). The Meissner Corpuscle Revised: A Multiafferented Mechanoreceptor with Nociceptor Immunochemical Properties. Check date values in:
|سال=(help) - Hashim, IH; Kumamoto, S; Takemura, K (2017). "Tactile Evaluation Feedback System for Multi-Layered Structure Inspired by Human Tactile Perception Mechanism". Sensors. 17 (11). doi:10.3390/s17112601.
- Buccino, G; Binkofski, F; Fink, GR (2001). "Action observation activates premotor and parietal areas in a somatotopic manner: an fMRI study". The European Journal of Neuroscience. 13 (2): 400-4. doi:10.1111/j.1460-9568.2001.01385.x.
- Seelke, AM; Padberg, JJ; Disbrow, E (2012). "Topographic Maps within Brodmann's Area 5 of macaque monkeys". Cerebral Cortex. 22 (8): 1834-5. PMC 3388892. PMID 2195592.
- Geyer S, Schleicher A, Zilles K, (1999). "Areas 3a, 3b, and 1 of Human Primary Somatosensory Cortex". NeuroImage. 10 (1): 63-83. doi:10.1006/nimg.1999.0440.
- Disbrow E, (2002). "Thalamocortical connections of the parietal ventral area (PV) and the second somatosensory area (S2) in macaque monkeys". Thalamus & Related Systems. 1 (4): 289-302. doi:10.1016/S1472-9288(02)00003-1.
- Saladin, KS (2004. McGraw-Hill, New York). Anatomy and Physiology 3rd edd. Check date values in:
|سال=(help) - Zukerman, Wendy (New Scientist. Retrieved 2015-01-22). Skin 'sees' the light to protect against sunshine. Check date values in:
|سال=(help) - Proske U, Gandevia SC, (2012). "The proprioceptive senses: their roles in signaling body shape, body position and movement, and muscle force". Physiological Reviews. 92 (4): 1651-97. PMID 23073629.
- Proske U, Gandevia SC, (2009). "The kinaesthetic senses". The Journal of Physiology. 587 (17): 4139-46. doi:10.1113/jphysiol.2009.175372. PMID 19581378.
- Case LK, Laubacher CM, Olausson H, Wang B, Spagnolo PA, Bushnell MC, (2016). "Encoding of Touch Intensity But Not Pleasantness in Human Primary Somatosensory Cortex". The Journal of Neuroscience. 36 (21): 5850-60. doi:10.1523/JNEUROSCI.1130-15.2016. PMC 4879201. PMID 27225773.
- Van Boven, R. W. ; Johnson, K. O. , (1994). "The limit of tactile spatial resolution in humans: Grating orientation discrimination at the lip, tongue, and finger". Neurology. 44 (12): 2361–2361. doi:10.1212/WNL.44.12.2361.
- Craig JC, (1999). "Grating orientation as a measure of tactile spatial acuity". Somatosensory & Motor Research. 16 (3): 197-268. doi:10.1080/08990229970456. PMID 10527368.
- Goldreich D, Wong M, Peters RM, Kanics IM, (۲۰۰۹). «A Tactile Automated Passive-Finger Stimulator (TAPS)». Journal of Visualized Experiments (به en doi=10.3791/1374). ۲۸. PMC 2726582. PMID 19578327.
- Stevens JC, Alvarez-Reeves M, Dipietro L, Mack GW, Green BG, (2003). "Decline of tactile acuity in aging: a study of body site, blood flow, and lifetime habits of smoking and physical activity". Somatosensory & Motor Research. 20 (3, 4): 271-9. doi:10.1080/08990220310001622997. PMID 14675966.
- Manning H, Tremblay F, (2006). "Age differences in tactile pattern recognition at the fingertip". Somatosensory & Motor Research. 23 (3, 4): 147-55. doi:10.1080/08990220601093460. PMID 17178550.
- Goldreich D, Kanics IM, (2003). "Tactile acuity is enhanced in blindness". The Journal of Neuroscience. 23 (8): 3439-45. PMID 12716952.
- Peters RM, Hackeman E, Goldreich D, (2009). "Diminutive digits discern delicate details: fingertip size and the sex difference in tactile spatial acuity". The Journal of Neuroscience. 29 (50): 15756-61. doi:10.1523/JNEUROSCI.3684-09.2009. PMC 3849661. PMID 20016091.
- Dillon YK, Haynes J, Henneberg M, (2001). "The relationship of the number of Meissner's corpuscles to dermatoglyphic characters and finger size". Journal of Anatomy. 199 (5): 577-84. doi:10.1046/j.1469-7580.2001.19950577.x. PMC 1468368. PMID 11760888.
- Peters RM, Goldreich D, (2013). "Tactile spatial acuity in childhood: effects of age and fingertip size". PLOS One. 8 (12): 8465e. doi:10.1371/journal.pone.0084650. PMC 3891499. PMID 24454612.
- Stevens, Joseph C. ; Foulke, Emerson; Patterson, Matthew Q, (1996). "Tactile acuity, aging, and braille reading in long-term blindness". Journal of Experimental Psychology: Applied. 2 (2): 106-91. doi:10.1037/1076-898X.2.2.91.
- Van Boven RW, Hamilton RH, Kauffman T, Keenan JP, Pascual-Leone A, (2000). "Tactile spatial resolution in blind braille readers". Neurology. 54 (12): 2230-6. doi:10.1212/wnl.54.12.2230. PMID 10881245.
- Goldreich D, Kanics IM, (2006). "Performance of blind and sighted humans on a tactile grating detection task". Perception & Psychophysics. 68 (8): 1363-71. doi:10.3758/bf03193735. PMID 17378422.
- Wong M, Gnanakumaran V, Goldreich D, (2011). "Tactile spatial acuity enhancement in blindness: evidence for experience-dependent mechanisms". The Journal of Neuroscience. 31 (19): 7028-37. doi:10.1523/JNEUROSCI.6461-10.2011. PMID 21562264.
- Bhattacharjee A, Ye AJ, Lisak JA, Vargas MG, Goldreich D, (2010). "Vibrotactile masking experiments reveal accelerated somatosensory processing in congenitally blind braille readers". The Journal of Neuroscience. 30 (43): 14288-98. doi:10.1523/JNEUROSCI.1447-10.2010. PMC 3449316. PMID 20980584.
- Gabriel Robles-De-La-Torre (Isfh.org. Archived from the original on 2010-03-07. Retrieved 2010-02-26). International Society for Haptics: Haptic technology, an animated explanation. Check date values in:
|سال=(help)
- مشارکتکنندگان ویکیپدیا. «Somatosensory System». در دانشنامهٔ ویکیپدیای انگلیسی.
مطالعه بیشتر
- Boron, Walter F.; Boulpaep, Emile L. (2003). Medical Physiology. Saunders. pp. 352–358. ISBN 0-7216-3256-4.
- Flanagan, J.R., Lederman, S.J. Neurobiology: Feeling bumps and holes, News and Views, Nature, 2001 Jul. 26;412(6845):389-91.
- Hayward V, Astley OR, Cruz-Hernandez M, Grant D, Robles-De-La-Torre G (2004). "Haptic interfaces and devices" (PDF). Sensor Review. 24 (1): 16–29. doi:10.1108/02602280410515770. Archived from the original (PDF) on 18 July 2006. Retrieved 28 February 2021.
- Purves, Dale (2012). Neuroscience, Fifth Edition. Sunderland, MA: Sinauer Associates, Inc. pp. 202–203. ISBN 978-0-87893-695-3.
- Robles-De-La-Torre G, Hayward V (July 2001). "Force can overcome object geometry in the perception of shape through active touch" (PDF). Nature. 412 (6845): 445–8. Bibcode:2001Natur.412..445R. doi:10.1038/35086588. PMID 11473320. S2CID 4413295. Archived from the original (PDF) on 3 اكتبر 2006. Retrieved 28 فوریه 2021. Check date values in:
|archive-date=(help) - Robles-De-La-Torre, G (2006). "The Importance of the Sense of Touch in Virtual and Real Environments" (PDF). IEEE Multimedia. 13 (3): 24–30. doi:10.1109/mmul.2006.69. S2CID 16153497. Archived from the original (PDF) on 24 January 2014. Retrieved 28 February 2021.
- Grunwald, M. (Ed.) Human Haptic Perception – Basics and Applications. Boston/Basel/Berlin: Birkhäuser, 2008, شابک ۹۷۸−۳−۷۶۴۳−۷۶۱۱−۶
- Encyclopedia of Touch Scholarpedia Expert articles
پیوندهای بیرونی
- Anatomy of Touch. Factual documentary series by BBC Radio 4.