نانوکریستالهای درمانی
در طی سالهای گذشته با کمک علم شیمی و کامپیوتر، طراحیهای زیادی برای ترکیبهای دارویی انجام شدهاست، هر چند حدود ۶۰٪ از این ساختارها در آب کم محلول هستند. فرموله کردن این ساختارها از مشکلات اساسی دانشمندان داروسازی است زیرا این دسته از ترکیبات، به دلیل سرعت انحلال پایین و پخش شدن آهسته، فراهمی زیستی و جذب کمی خواهند داشت. برای جذب خوراکی، داروها باید بتوانند شیب غلظتی مناسبی را بین محیط گوارشی و جریان خون ایجاد نمایند؛ ولی در مورد داروهای کم محلول این شیب غلظتی کم و در نتیجه جذب نیز کم میشود. در راههای غیر خوراکی نیز، اگر دارو کم محلول باشد به خوبی در محل تزریق حل نمیشود و در نتیجه نمیتوان سطح مناسبی از دارو را در خون ایجاد نمود. برای رفع این مشکلات راه حلهایی نظیر استفاده از ایجاد نمک، کمکحلالها، داخل کردن به سیکلودکسترینها (ساختارهایی شبیه به سبد با حفرهای در وسط که قابلیت ورود ترکیبات به درون این حفره وجود دارد) یا استفاده از حاملها نظیر پراکندگی جامدات و لیپوزومها ارائه شدهاست. متأسفانه استفاده از این راهکارها برای همه داروها ممکن نیست مثلاً برخی داروها به سختی به یون تبدیل میشوند تا بتوان از آنها نمک ایجاد نمود، یا برای داخل شدن به ساختار سیکلودکسترینها مناسب نیستند. همچنین افزودنیهایی که در فرمولاسیونها استفاده میشود همیشه کمک کننده نیست. بهطور مثال محلول دارویی تزریقی تاکسول که امروزه در بازار دارویی وجود دارد حاوی مقادیر بالایی از Cremophor EL است که برای بهبود فراهمی زیستی پاکلیتاکسول مورد استفاده قرار گرفتهاست اما موجب عوارض جانبی نظیر شوک آلرژیک میشود. در دهه ۹۰ میلادی، نانوکریستالهای دارویی توجه محققین دارویی را به خود جلب نمود. نانوکریستالهای دارویی، پراکندگی کلوئیدی با اندازه کمتر از میکرومتر میباشند که تقریباً حاوی ۱۰۰٪ ماده فعال دارویی بوده و با کمک مقادیر ناچیز از پایدارکنندههایی نظیر پلیمرها یا سورفاکتانتها پایدار میشوند. محیط پراکنده کنندهٔ این ساختارها میتواند آب، محلولهای مایی یا غیر مایی (مثل پلی اتیلن گلیکول مایع یا روغنها) باشد. بسته به تکنولوژی ساخت، ذرات جامد ایجاد شده میتوانند آمورف یا کریستالی باشند که در نتیجه این ذرات، نانوکریستال در ساختار آمورف نیز نامیده میشوند.
| این نوشتار نیازمند پیوند میانزبانی است. در صورت وجود، با توجه به خودآموز ترجمه، میانویکی مناسب را به نوشتار بیفزایید. |
مزایای نانوکریستالها
- افزایش سرعت انحلال
با کاهش اندازه ذره سطح تماس بین ذره و محیط اطراف افزایش یافته و در نتیجه سرعت انحلال (که به میزان سطح تماس مرتبط است) افزایش مییابد.
- احتمال ایجاد ساختارهای آمورف و مزایای آن
ساختارهای آمورف سرعت انحلال بیشتری دارند در نتیجه اگر حین تولید این ساختارها ایجاد شوند زمان مورد نیاز برای انحلال کمتر شده و سرعت اثر دارو افزایش مییابد.
- بهبود ویژگیهای زیستی
همانطور که در مقالات قبل نیز ذکر شدهاست، نانوذرات نسبت به ذرات بزرگتر از نظر جذب و اثربخشی بهتر عمل میکنند.
روشهای تهیه نانوذرات کریستالی
در کل روشهای تولید نانوذرات کریستالی به دو دسته بالا- پایین (top-down) و پایین- بالا (down-top) تقسیم میشوند. روش پایین- بالا مانند روش رسوبی به این معنا است که نانوکریستالها از مولکولها ساخته میشوند اما در روش بالا- پایین مانند تکنیک هموژنایز کردن و سایش دانهای، نانوکریستالها با تخریب و واپاشی مرحله به مرحله از پودر سخت ایجاد میگردند.
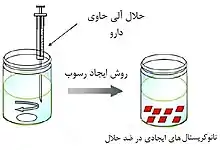
تکنولوژی رسوبی (Precipitation technique)
داروی کم محلول در آب، در یک حلال (غالباً حلال آلی) حل و محلول به یک ضد حلال (antisolvent) قابل امتزاج با آب (حلال مایی) اضافه و چرخیده میشود. با این کار اشباع سریع رخ داده و موجب هسته زایی و ایجاد رسوب میگردد. روش رسوبی این مزیت را دارد که یک داروی خاص میتواند در حلالهای مختلف، میزان انحلالهای متفاوتی داشته باشد که این امر خود بر هسته زایی مؤثر است. هرچند ذرات ایجاد شده در فرمولاسیون نهایی میتوانند رشد کنند و با افزایش اندازه، موجب بروز مشکلاتی در فراوردههای دارویی شوند. برای جلوگیری از این پدیده اغلب پایدارکنندهها به فرمولاسیون اضافه میشود. در روش رسوبی، برخی از عوامل بر اندازه و یکسانسازی ذرات اثرگذار است:
- سرعت چرخش
- نسبت حلال به ضد حلال
- مقدار دارو
- دما
با افزایش سرعت چرخش، ذرات کوچکتر میشوند زیرا سرعت بالاتر، پخش شدن دارو را بین فازها افزایش داده و موجب ازدیاد تعداد هستههای ایجاد شده و در نتیجه تولید ذرات کوچکتر میگردد. اگر نسبت ضد حلال به حلال نیز افزایش یابد موجب اشباعپذیری بین سطوح فازها و هسته زایی سریعتر میشود. میزان داروی وارد شده نیز نباید زیاد باشد زیرا موجب افزایش احتمال تجمع ذرات اطراف هم و بزرگتر شدن آنها میگردد. در این روش معمولاً دما را نیز پایین در نظر میگیرند. در دمای پایینتر اشباع پذیری سریع تر انجام میشود به علاوه، با توجه به گرمازا بودن واکنش هسته زایی، هرچه دما کمتر باشد هسته زایی بهتر انجام میشود. روش رسوبی ساده و مقرون به صرفه است و نیاز به تجهیزات گرانقیمت ندارد. بهعلاوه به دلیل عدم نیاز به انرژی بالا برای انجام آن، احتمال تخریب دارو نیز کاهش مییابد. گاه با استفاده از این روش، اشکال آمورف نیز ایجاد میشود که موجب افزایش سرعت انحلال دارو میگردد. اشکال آمورف یک عیب دارند و آن این است که حالتهای آمورف با انرژی بالاتر تمایل دارند به فرم کریستاله که پایدارتر است برسند و این مورد بر پایداری دارو مؤثر خواهد بود. باقی ماندن حلال در محصول نهایی و نیاز به محلول بودن دارو در حداقل یک حلال، از دیگر محدودیتهای این روش برای تولید نانوذرات کریستالی است.
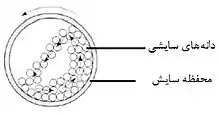
روش سایش دانهای (Pearl milling technique)
در این روش دارو، سورفاکتانت و آب وارد محفظهٔ سایش حاوی دانههای سایشی (milling pearls) که از جنس شیشه، زیرکونیوم اکسید یا رزین پلی استایرن هستند شده و با چرخش دانهها با انرژی بالا، دارو به نانوذره تبدیل میشود (شکل ۳). در کل، بهینهسازی این روش به عوامل زیر بستگی دارد:
- میزان دارو
- تعداد دانههای سایشی
- سرعت سایش
- زمان سایش
- دما
اگر میزان دارو و زمان سایش زیاد باشد، احتمال تجمع ذرات و کلوخه شدن آنها افزایش مییابد. با افزایش سرعت سایش و نیز تعداد دانههای سایشی، میزان انرژی مصرفی توسط دستگاه بیشتر میشود که از نظر اقتصادی مقرون به صرفه نیست. در برخی گزارشها ذکر شدهاست که کاهش دما از کلوخه شدن ذرات جلوگیری مینماید. به همین دلیل در بسیاری از فرایندهای تولید، با وارد کردن نیتروژن مایع دمای محفظهٔ سایش را کاهش میدهند. روش سایش دانهای ساده است و برای داروهای نامحلول در محیط مایی و غیر مایی کاربرد دارد. این فرایند در حجمهای مختلف از میلی لیتر تا لیتر قابل استفاده است و در نتیجه هم در آزمایشگاههای تحقیقاتی و هم در صنعت قابلیت اجرا دارد. اولین محصولی که با این روش تولید شد، Rapamune® بودهاست که در سال ۲۰۰۰ معرفی گردید. این روش تولید در مقایسه با تکنیک رسوبی نیاز به انرژی بیشتری دارد. به علاوه این نگرانی نیز وجود دارد که با سایش دانهها ترکیباتی از آنها وارد محصول شده و موجب آلودگی محصول نهایی شود. همچنین این روش زمانبر است و این زمان ممکن است از چند ساعت تا چند روز ادامه یابد که همین موضوع احتمال آلودگی میکروبی فراورده را افزایش میدهد.
روش هموژنایز کردن با فشار بالا (High-pressure homogenization technique)
در این روش، سوسپانسیونی حاوی دارو، سورفاکتانت و آب از یک شکاف بسیار باریک با سرعت بسیار بالا عبور کرده و ذرات را به اندازه نانو درمیآورد. این روش نیز مانند روش سایش دانهای، برای داروهای نامحلول در محیط مایی و غیر مایی مناسب است.

عوامل زیر بر بهینه عمل کردن این روش مؤثر هستند:
- سختی ترکیبات وارد شده
- فشار اعمال شده
- تعداد دفعات هموژنایز کردن
- دما
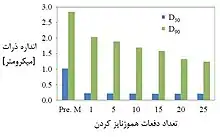
با افزایش فشار اعمال شده معمولاً اندازه ذرات کاهش مییابد. اغلب در آزمایشگاهها حداکثر فشار لازم برای تهیه نانوذرات کریستالی دارویی حدود ۱۵۰۰ بار است. البته هر چه ذرات سختتر باشند فشار لازم برای کاهش اندازه آنها بیشتر خواهد بود. هرچه تعداد دفعات هموژنایز کردن بیشتر شود، ذرات اندازه یکسانتری خواهند داشت. با کمک شکل ۵ این موضوع روشنتر خواهد شد. طی یک تحقیق اثر تعداد دفعات هموژنایز کردن بر اندازه ذرات بررسی شد و نشان داد که با افزایش تعداد دفعات قطر کلی ذرات به هم نزدیکتر شده و گستردگی اندازه ذرات که یکی از معایب تولید است، کاهش مییابد.
با انجام عمل هموژنایز کردن دمای محفظه انجام فرایند افزایش مییابد که برای داروهای حساس به حرارت مناسب نیست در نتیجه اغلب از یک دستگاه خنککننده در این روش استفاده میشود. یک مزیت عمده در این روش قابلیت تولید زیاد محصول بدون نگرانی از آلوده شدن آن است که نسبت به روش سایش دانهای یک مزیت بزرگ محسوب میشود.
نسل دوم نانوکریستالها
محصولاتی را که با بکارگیری روشهایی که تاکنون نام برده شد تولید میشوند، نسل اول نانوکریستالها گویند. در نسل دوم از مخلوطی از روشها برای تولید استفاده میشود. اصل این روشها بر پایه هموژنایز کردن است با این تفاوت که پیش از ورود ذرات به هموژنایزر یکسری عملیات بر روی آنها صورت میگیرد. جدول زیر بهطور خلاصه نام فرایندهای نسل دوم و پیش عملیات لازم بر روی ذرات قبل از مرحله هموژنایز کردن را نشان میدهد.
مزیتهای نسل دوم نانوکریستالها
- نانوکریستالهای کوچکتر
در نسل اول اغلب ذرات ایجاد شده اندازهای کمتر از ۲۰۰ نانومتر دارند اما در نسل دوم این محدوده کوچکتر شده و به زیر ۱۰۰ نانومتر میرسد.
- افزایش پایداری فیزیکی
با همراهی روشهایی نظیر سایش و هموژنایز کردن در نسل دوم نانوکریستالها، در حقیقت از دو راه اندازه ذرات کاهش مییابد که این امر به کم شدن گستره اندازه ذرات کمک میکند. هرچه ذرات اندازه مشابهتری داشته باشند احتمال تجمع و کلوخه شدن آنها کاهش مییابد که این امر خود از مزایای نسل دوم نسبت به نسل اول است.
داروهای وارد شده به بازار
- ®Rapamune حاوی داروی سیرولیموس است که به عنوان سرکوب کننده ایمنی بکار میرود. این دارو به دو صورت سوسپانسیون خوراکی و قرص در بازار وجود دارد که البته قرصها ۲۱٪ فراهمی زیستی بالاتری دارند.
- ® Emend حاوی داروی Aprepitant است که یک ضد تهوع میباشد. این دارو برخلاف اغلب داروهای ضد تهوع در شیمی درمانی که به صورت تزریقی مصرف میشوند، به صورت قرص بوده و همین امر یک مزیت عمده محسوب میشود که باعث بیشتر شدن همراهی بیمار میگردد.
- ® TriCor حاوی داروی Fenofibrate است. اثر دارو بسته به آنکه بیمار دارو را با معده پر یا خالی مصرف کند متفاوت است. هنگام پر بودن معده انحلال افزایش یافته و جذب بیشتر میشود. با کاهش اندازه این دارو به نانوذرات، حلالیت دارو افزایش مییابد و دیگر تفاوتی بین خالی یا پر بودن معده بیمار وجود ندارد. فرمولاسیون دیگر حاوی این دارو که به صورت نانوکریستال است ®Triglide نام دارد.
- محصول دیگر ®Megace است که حاوی داروی Megestrol میباشد. مزیت این فرمولاسیون که به صورت پودر است، راحتتر بودن بلع توسط بیمار به علت کاهش گرانروی دارو در فرم نانو و نیز کمتر بودن حجم داروی مصرفی میباشد.
داروهای دیگری نیز به صورت نانوکریستال وجود دارند که در حال گذراندن مراحل بالینی برای ورود به بازار دارویی هستند.
محدودیتهای نانوکریستالها
نانوذرات با اندازههای کمتر از ۱۵۰ نانومتر احتمال سمیت سلولی را افزایش میدهند زیرا این ساختارها توانایی ورود به همه سلولهای بدن و ایجاد سمیت در آنها را دارند. به علاوه این روش تولید اغلب برای داروهای دسته II در داروسازی یعنی داروهایی با انحلال کم و در عین حال قابلیت نفوذ بالا به بافتها قابل استفاده است.
نتیجهگیری
نانوکریستالهای دارویی یکی از مهمترین راههای فرمولاسیون برای داروهای کم محلول است که تاکنون معرفی شدهاست. این فرمولاسیونها ساده بوده و نیاز به همراهی ترکیبات دیگر (که خود میتوانند باعث ایجاد عوارض شوند) برای بهینهسازی ندارند. با توجه به آنکه تعداد داروهای معرفی شده کم محلول در حال افزایش است، گمان میرود که نانوکریستالها بتوانند در آینده جایگاه مناسبی را در بین فرمولاسیونهای دارویی برای وارد کردن این داروها داشته باشند.
منابع
- ویکیپدیای انگلیسی
- مهندس حسین تویسرکانی، اصول علم مواد (خواص و مهندسی مواد)، مرکز نشر دانشگاه صنعتی اصفهان، ۱۳۷۶، شابک ۹۶۴-۶۰۲۹-۱۴-۰