ضریب تراکم اتمها
در کریستالوگرافی ضریب تراکم اتمها (APF) یا بازده تراکم یا کسر تراکم کسری از حجم اشغال شده توسط ذرات تشکیل دهنده یک ساختار بلوری است. این کسر همواره یک کمیت بدون بعد و کمتر از یک واحد است. در سیستم اتمی، تعریف شده توسط کنوانسیون، ضریب تراکم اتمها با این فرض که اتمهای کرههای سختی هستند تعریف میشود. شعاع این کرههای سخت در بیشترین مقدار ممکن در نظر گرفته شدهاست بهطوری که اتمها با هم همپوشانی ندارند. برای کریستالهای تک جزئی (آنهایی که فقط شامل یک نوع ذره میشوند) کسر تراکم با زبان ریاضی اینگونه نمایش داده میشود:
که در آن Nparticle است که تعداد ذرات در سلول واحد، Vparticle حجم هر ذره است و Vunit cell حجم اشغال شده توسط سلول واحد است. میتوان به کمک ریاضی اثبات کرد که برای ساختارهای تک جزئی، متراکمترین آرایش اتم دارای ضریب تراکم اتمی ای در حدود ۰٫۷۴ است. برای ساختارهای چند جزئی (مانند آلیاژهای بینابینی) APF میتواند بیش از ۰٫۷۴ باشد.
ضریب تراکم اتمی یک سلول واحد در مطالعه علم مواد است که در آن توضیح میدهد که بسیاری از خواص مواد مثل، فلزات با ضریب تراکم اتمی بالا «کارایی» (انعطافپذیری)بالاتری دارند، همانطور که جاده ای که در آن سنگها به هم نزدیکترند صافتر است، انعطافپذیری به اتمهای فلزی اجازه میدهد تا راحتتر روی هم بلغزند.
ساختارهای کریستالی تک جزئی
تراکمهای کروی گرفته شده بر روی سیستمهای اتمی با کسر ضریب تراکم مربوط به صورت زیر لیست شدهاست:
ساختار هگزاگونال متراکم:0.74[1]
اکثر فلزات ساختار HCP, FCC یا BCC دارد.[2]
.svg.png.webp)
ساختار مکعب ساده
ساختار مکعب مرکز دار
.svg.png.webp)
سلول واحد اولیه ساختار کریستای مکعب مرکز دار شامل چندین بخش گرفته شده از نه اتم (اگر ذرات موجود در کریستال اتم باشند) است: یک اتم در هر یک از گوشههای مکعب و یک اتم در مرکز مکعب. چرا که حجم هر یک از اتمهای هشت گوشه بین هشت سلول مجاور به اشتراک گذاشته شدهاست. هر واحد BCC در بر گیرنده معادل حجم دو اتم (یکی مرکز و یکی در گوشهها) میباشد.
هر گوشه از اتم مرکز اتم را لمس میکند. یک خط کشیده شدهاست که از یک گوشه مکعب که از مرکز رد میشود و به گوشه ای دیگر وصل میشود از 4r میگذرد که در آن r شعاع اتمها است. از روی مباحث علم هندسه میدانیم که طول قطر مکعبa√۳ است؛ بنابراین طول ضلع هر وجه از ساختار BCC را میتوان به شعاع اتمها توسط فرمول زیر ربط داد:
با دانستن این فرمول و فرمول محاسبه حجم یک کره، محاسبه APF به شرح زیر ممکن میشود:
ساختار هگزاگونال متراکم
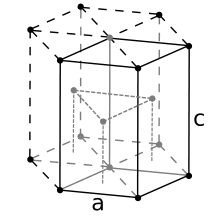
برای شش ضلعی متراکم ساختار مشابه مشتقاتش است. در اینجا سلول واحد (معادل ۳سلول واحد اولیه) یک منشور شش ضلعی شامل شش اتم (اگر ذرات در کریستال اتم باشند). در واقع سه اتم در لایه میانی (در داخل منشور); علاوه بر این برای لایهها بالایی و پایینی (بر اساس منشور) اتم مرکزی با سلولهای مجاور به اشتراک گذاشته شدهاست و هر یک از شش اتم در راس مشترک با پنج سلول مجاور دیگر به اشتراک گذاشته شدهاست؛ بنابراین تعداد کل اتمها در سلول ۳ + (۱/۲)×۲ + (۱/۶)×۶×۲ = ۶. هر اتم دوازده اتم دیگر را لمس میکند. در حال حاضر از پایه منشور و ارتفاع منشور است. دومی دو برابر فاصله بین لایههای مجاور است.دو برابر ارتفاع چهار ضلعی منظم که رأس آنها توسط (میگویند) اتم مرکزی لایه پایین اشغال شدهاست دو اتم مجاور غیر مرکزی از همان لایه و یک اتم از لایه میانی بر روی سه اتم گفته شده در بالا ساکن است. بدیهی است که طول ضلع این چهار ضلعی . اگر سپس ارتفاع آن را میتوان به راحتی محاسبه کرد که میشودو از این رو . بنابراین حجم سلول واحد HCP برابر میشود با ۳/۲√3a^2 cکه همان
پس از آن APF را به شکل زیر محاسبه کرد:
منابع
- Ellis, Arthur B.; et al. (1995). Teaching General Chemistry: A Materials Science Companion (3rd ed.). Washington, DC: American Chemical Society. ISBN 0-8412-2725-X.
- Moore, Lesley E.; Smart, Elaine A. (2005). Solid State Chemistry: An Introduction (3rd ed.). Boca Raton, Florida: Taylor & Francis, CRC. p. 8. ISBN 0-7487-7516-1.
برای مطالعهٔ بیشتر
- Schaffer; Saxena; Antolovich; Sanders; Warner (1999). The Science and Design of Engineering Materials (2nd ed.). New York, NY: WCB/McGraw-Hill. pp. 81–88. ISBN 978-0-256-24766-4.
- Callister, W. (2002). Materials Science and Engineering (6th ed.). San Francisco, CA: John Wiley and Sons. pp. 105–114. ISBN 978-0-471-13576-0.