آگارز
آگارز یک ماده پلیمری پلی ساکاریداست که عموماً از برخی جلبک دریایی قرمز استخراج میشود..[1] Agarose یک پلیمر خطی است که از واحد تکرار آگاروبیوز تشکیل شدهاست که یک دی ساکارید از D-گالاکتوز و ۳،6-anhydro-L-galactopyranose است. آگاروز یکی از دو مؤلفه اصلیآگار است و با حذف آگارپوکتین از آگار از تخمیر آگار خارج میشود.[2]
.jpg.webp)
آگارز در زیستشناسی مولکول برای جداسازی مولکولهای بزرگ، به ویژه DNA، توسط الکتروفورز استفاده میشود. صفحات ژل آگارز (معمولاً ۰٫۷ تا ۲٪) برای الکتروفورز به راحتی توسط ریختن محلول گرم و مایع به یک قالب تهیه میشوند. طیف گستردهای از آگارزهای مختلف وزن مولکولی و خواص مولکولی مختلف برای این منظور در دسترس هستند. آگاروز همچنین ممکن است به دانهها شکل داده شود و در تعدادی از روشهای کروماتوگرافی برای تصفیه پروتئین استفاده شود.
آ
ساختار
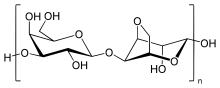
آگاروز یک پلیمر خطی با وزن مولکولی حدود ۱۲۰٬۰۰۰ است که شامل D-گالاکتوز متناوب و ۳،6-anhydro-L-galactopyranose مرتبط با پیوندهای گلیکوزییدی α- (۱ → ۳) و β- (۱ → ۴) است. ۳،6-anhydro-L-galactopyranose یک L-گالاکتوز با یک پل Anhydro بین موقعیتهای ۳ و ۶ است، اگر چه برخی از واحد L-galactose در پلیمر ممکن است پل نباشد. برخی از واحدهای D-گالاکتوز و L-گالاکتوز میتوانند متیل شوند، و پیروات و سولفات نیز در مقادیر کم یافت میشوند.
هر زنجیره آگارز حاوی ~ ۸۰۰ مولکول گالاکتوز است و زنجیرههای پلیمر آگارز الیاف اسپیلمی را تشکیل میدهند که به ساختار سوپوکیول با شعاع ۲۰ تا ۳۰ نانومتر متصل میشوند. الیاف شبه سفت و سخت هستند و طیف گستردهای از طول بسته به غلظت آگارز دارند. هنگامی که جامد میشود، فیبرها یک شبکه سه بعدی از کانالهای قطر بین ۵۰ نانومتر تا ۲۰۰ نانومتر را تشکیل میدهند، بسته به غلظت آگارز مورد استفاده - غلظتهای بالاتر باعث پایین آمدن قطر منافذ میشود. ساختار 3-D همراه با پیوندهای هیدروژن نگهداری میشود و بنابراین میتواند با گرم شدن به حالت مایع متلاشی شود.
خواص
آگارز به عنوان یک پودر سفید موجود است که در آب جوش نزدیک به آب جوش قرار میگیرد و زمانی که آن را خنک میکند ژل را تشکیل میدهد. Agarose پدیده هیستریتیز حرارتی را در انتقال آن به مایع به ژل نشان میدهد، یعنی آن ژلها و ذوب در دماهای مختلف. درجه حرارت ذوب و ذوب بستگی به نوع آگارز دارد. آگارزهای استاندارد مشتق شده از Gelidium دارای درجه حرارت زنگ زده از ۳۴–۳۸ درجه سانتی گراد (۹۳–۱۰۰ درجه فارنهایت) و دمای ذوب ۹۰–۹۵ درجه سانتی گراد (۱۹۴–۲۰۳ درجه فارنهایت) است، در حالی که آنهایی که از Gracilaria گرفته شدهاست، جایگزین متوقیز، دمای ملایم ۴۰–۵۲ درجه سانتیگراد (۱۰۴–۱۲۶ درجه فارنهایت) و دمای ذوب ۸۵–۹۰ درجه سانتیگراد (۱۸۵–۱۹۴ درجه فارنهایت) دارد. درجه حرارت ذوب و زنگ زدگی ممکن است وابسته به غلظت ژل، به ویژه در غلظت کم ژل کمتر از ۱٪ باشد؛ بنابراین، درجه حرارت ذوب و ذوب در یک غلظت آگارز مشخص شدهاست.
آگارز طبیعی حاوی گروههای متیل تخلیه شدهاست و میزان متیلاسیون بهطور مستقیم با دمای ژل شدن متناسب است. با این وجود، متیلاسیون مصنوعی اثر معکوس دارد، در نتیجه افزایش متیلاسیون باعث کاهش دمای ژل شدن میشود. انواع آگارزهای اصلاح شده شیمیایی با دمای مختلف ذوب و زلزله از طریق تغییرات شیمیایی در دسترس هستند.
در موقع قرار دادن ژل آگاروز مستعد سینرژیز (اکستروژن آب از طریق سطح ژل) است، اما این روند به اندازه کافی آهسته است که با استفاده از ژل مواجه نشود.
ژل آگارز میتواند دارای ژل قوی در غلظت کم باشد، و آن را به عنوان یک محیط ضد کنوانسیون برای الکتروفورز ژل مناسب است. ژل آگارز به عنوان ۰٫۱۵٪ رقیق میتواند اسلب برای الکتروفورز ژل ایجاد کند. پلیمر آگارز حاوی گروههای شارژ، به خصوص پیروات و سولفات است. این گروههای بارگیری منفی میتوانند حرکت DNA را در فرایندی به نام الکتروندوزموز (EEO) کاهش دهند و از این رو EEAE پایین آگارز بهطور کلی برای استفاده در الکتروفورز ژل آگارز اسیدهای نوکلئیک ترجیح داده میشود. آگارز Zero EEO نیز در دسترس است، اما ممکن است برای برخی از برنامهها نامطلوب باشد، زیرا ممکن است با افزودن گروههای مثبت شارژ که میتوانند بر واکنشهای آنزیم بعدی تأثیر بگذارند، ساخته شوند. Electroendosmosis یک دلیل برای آگارز است که بهطور عمده از آگار استفاده میشود به عنوان آگارپپتین در آگار حاوی مقدار قابل توجهی از سولفات و گروه کربوکسیل بار منفی است. حذف آگاروپتین در آگارز بهطور قابل ملاحظه ای باعث کاهش EEO و همچنین کاهش جذب غیرمستقیم بیومولکولها به ماتریکس ژل میشود. با این حال، برای برخی از برنامههای کاربردی مانند الکتروفورز پروتئین سرم، EEO بالا ممکن است مطلوب باشد و آگاروپتین ممکن است در ژل مورد استفاده قرار گیرد.[3]
آگارزهای دمای ذوب پایین
دمای ذوب و زرد شدگی آگارز را میتوان با اصلاحهای شیمی، اغلب توسط هیدروکسی ایتیلاسیون اصلاح کرد، که باعث کاهش تعداد پیوندهای هیدروژنی میشود، که منجر به کاهش ذوب و دمای تنظیم شده نسبت به آگارزهای استاندارد میشود. دمای دقیق به وسیله درجه جایگزینی تعریف میشود و بسیاری از آگارزهای با دمای پایین ذوب (LMP) در محدوده ۳۰–۳۵ درجه سانتیگراد (۸۶ تا ۹۵ درجه فارنهایت) باقی میماند. این ویژگی باعث میشود که دستکاریهای آنزیمی بهطور مستقیم پس از الکتروفورز ژل انجام شود، با اضافه کردن برشهای ژل مفتولی که حاوی یک قطعه DNA متمایز برای مخلوط واکنش هستند. آگارز LMP حاوی سولفات کمتر است که میتواند بر برخی از واکنشهای آنزیمی تأثیر بگذارد و بنابراین برای برخی از برنامهها مورد استفاده قرار میگیرد. هیدروکسی اتیلسیون ممکن است با کاهش چگالی بستهبندی بستههای آگارز، اندازه ذرات را کاهش دهد، بنابراین ژل LMP همچنین میتواند بر زمان و جداسازی در طی الکتروفورز تأثیر داشته باشد. آگارزهای با دمای پایین ذوب یا جوشیدن ممکن است تنها در دمای ۸ تا ۱۵ درجه سانتیگراد (۴۶–۵۹ درجه فارنهایت) باشند..
برنامههای کاربردی

e یک ماتریس ترجیحی برای کار با پروتئینها و اسیدهای نوکلئیک است زیرا دارای طیف وسیعی از ثبات فیزیکی، شیمیایی و حرارتی است و درجه پایینتر از پیچیدگیهای شیمیایی آن نیز کمتر احتمال دارد با مولکولهای زیستی ارتباط برقرار کند. آگارز به عنوان وسیله ای برای جداسازی الکتروفورز مقیاس تحلیلی در الکتروفورتیک ژل آگارز استفاده میشود. ژل ساخته شده از آگارز خالص دارای اندازه منافذ نسبتاً بزرگ هستند و آنها را برای جداسازی مولکولهای بزرگ مانند پروتئینها و پروتئین ها> ۲۰۰ کیلوالتون و همچنین قطعات DNA> 100 پایه پایه مفید میسازد. آگاروز نیز بهطور گستردهای برای تعدادی از برنامههای کاربردی دیگر، به عنوان مثال immunodiffusion و ایمونوالکتروفورز استفاده میشود، به عنوان الیاف agarose به عنوان یک لنگر برای immunocomplexes عمل میکند.
الکتروفورز ژل آگارز
الکتروفورز ژل آگارز روش معمولی برای حل DNA در آزمایشگاه است. ژل آگارز دارای قدرت حل پائینی DNA پایینتر از ژلهای آکریل آمید است، اما آنها دامنه وسیعی از جداسازی را دارند و بنابراین معمولاً برای قطعات DNA با اندازههای ۵۰ تا ۲۰٬۰۰۰ ب.آر. پی استفاده میشوند، اگرچه با استفاده از الکتروفورز ژل فیلد پالس (PFGE) همچنین میتواند برای جداسازی پروتئینهای بزرگ استفاده شود و ماتریس مورد نظر برای الکتروفورز ژل ذرات با شعاع مؤثر بزرگتر از ۵ تا ۱۰ نانومتر است.
اندازه منافذ ژل بر اندازه DNA است که میتوان آن را سوراخ کرد. پایینتر غلظت ژل، بزرگتر اندازه منافذ، و بزرگتر DNA است که میتواند برش. با این حال ژلهای با غلظت کم (۰٫۱–۰٫۲٪) شکننده هستند و از این رو سخت به کار میروند و الکتروفورز مولکولهای بزرگ DNA میتواند چندین روز طول بکشد. محدودیت حلال برای الکتروفورز استاندارد ژل آگارز حدود ۷۵۰ کیلو بایت است. این حد را میتوان توسط PFGE غلبه کرد، جایی که میدانهای متناوب الکتریکی متناوب به ژل اعمال میشود. قطعات DNA خود را تغییر میدهند زمانی که میدان کاربردی مسیر را عوض میکند، اما مولکولهای بزرگتر DNA طول میکشد تا زمانی که میدان الکتریکی تغییر میکند، خودشان را تغییر دهند، در حالی که برای کوچکترها سریعتر است و بنابراین DNA میتواند به اندازه اندازهگیری شود.
ژل آگارز به صورت افقی در یک قالب قالب بندی میشود، و هنگامی که تنظیم میشود، معمولاً به صورت افقی در یک محلول بافر فرومیرود. DNA معمولاً با رنگ آمیزی با اتیدیوم برماید تجسم داده شده و سپس تحت نور UV قرار میگیرد، اما روشهای دیگر رنگ آمیزی در دسترس هستند مانند SYBR Green, GelRed، متیلن آبی و کریستال بنفش. اگر قطعات DNA جدا شده برای آزمایش بعدی در پایین نیاز باشد، میتوان آنها را از ژل در برشها برداشت تا دستکاری بیشتری شود.

تصفیه پروتئین
ماتریکس ژل آگارز اغلب برای تصفیه پروتئین استفاده میشود، به عنوان مثال، در جداسازی مقیاس تهیه شده در ستون به عنوان کروماتوگرافی ژل فیلتراسیون، کروماتوگرافی جذبی و کروماتوگرافی تبادل یونی. با این حال به عنوان یک ژل پیوسته استفاده نمیشود، بلکه به دانههای متخلخل یا رزینهای متنوعی تبدیل میشود. دانهها بسیار متخلخل هستند به طوری که پروتئین میتواند آزادانه از طریق دانه عبور کند. این دانههای مبتنی بر آگارز بهطور کلی نرم و راحت خرد میشوند، بنابراین آنها باید تحت جریان جاذبه، سانتریفیوژ با سرعت پایین یا روشهای کم فشار مورد استفاده قرار گیرند. مقاومت رزینها میتواند با افزایش اتصال متقابل و سخت شدن شیمیایی رزینهای آگارز بهبود یابد، اما این تغییرات همچنین ممکن است باعث کم شدن ظرفیت اتصال پروتئین در برخی از روشهای جداسازی مانند کروماتوگرافی جذب شود.
آگاروز یک ماده مفید برای کروماتوگرافی است چرا که بیومولکولها را به میزان قابل توجهی جذب نمیکند، دارای خواص جریان خوب است و میتواند شدت pH و قدرت یونی و همچنین غلظت بالا دنتورانتها مانند اوره 8M یا 6M گوانیدین HCl را تحمل کند. نمونههایی از ماتریس مبتنی بر آگارز برای کروماتوگرافی فیلتراسیون ژل Sepharose و WorkBeads 40 SEC (cross-linked agarose), Praesto و Superose (با آگارزهای بافندگی بسیار متقاطع) و Superdex (دگز کلان به صورت کووالانسی با آگاروز) مرتبط است.
برای کروماتوگرافی جذبی، آگاروز مگس، رزین ماتریکس است که اغلب مورد استفاده قرار میگیرد برای اتصال لیگاندها که پروتئین را متصل میکنند. لیگاندها به صورت کووالانسی از طریق اسپریر به گروه هیدروکسیل فعال پلیمر مهره ای agarose مرتبط میشوند. پروتئینهای مورد علاقه پس از آن میتوانند به صورت لیگاندانه به یکدیگر متصل شوند تا از پروتئینهای دیگر جدا شوند و پس از آن میتوانند از آن جدا شوند. دانههای agarose مورد استفاده معمولاً دارای ۴٪ و ۶٪ تراکم با ظرفیت اتصال مناسب برای پروتئین هستند.
گاهی اوقات میتوان از آگارز به جای آگار برای کشت ارگانیسمها استفاده کرد زیرا آگار ممکن است حاوی ناخالصیهایی باشد که میتواند بر رشد ارگانیسم یا برخی از روشهای پایین دست مانند PCR تأثیر بگذارد. آگاروز همچنین سختتر از آگار است و بنابراین ممکن است که جایی که لازم است ژل قوی تر باشد، ممکن است ترجیح داده شود و دمای پایین ژل شدن آن ممکن است سبب جلوگیری از شوک حرارتی موجود در ارگانیسم شود که سلولها قبل از ژل در مایع به حالت تعلیق درآید. این میتواند برای کشت باکتریهای اتوترروفی سخت، پروتئین گیاهی، Caenorhabditis elegans، دیگر ارگانیزمها و سلولهای مختلف استفاده شود.
آگاروز اغلب به عنوان یک حمایت از فرهنگ سه بعدی سلولهای انسان و حیوان مورد استفاده قرار میگیرد. از آنجا که آگاروز هیدروژلهای غیر سیتوتوکسی را تشکیل میدهد، میتواند برای تولید محیط طبیعی سلولهای بدن انسان، ماتریکس خارج سلولی مورد استفاده قرار گیرد. با این حال، آگارز یک هیدروژل بی هوازی سفت ایجاد میکند که هیچ اطلاعات بیولوژیکی را حمل نمیکند، بنابراین سلولهای انسان و حیوان نمیتوانند به پلی ساکارید پایبند باشند. به دلیل این خواص خاص، آگارز هیدروژل محیط طبیعی سلولهای غضروفی را تقلید میکند و نشان داده شدهاست که تمایز متقابل کندروسیتها را به غضروف حمایت میکند. به منظور تغییر خواص مکانیکی آگارز برای تولید محیط طبیعی دیگر سلولهای انسانی، آگارز میتواند از طریق اکسیداسیون دقیق الکل اولیه D-گالاکتوز به کربوکسیلیک اسید اصلاح شود. این اصلاح شیمیایی کلاس جدیدی از مواد به نام آگارز کربوکسیل ارائه میدهد. از طریق کنترل تعداد D-گالاکتوز کربوکسیلیک در ستون فقرات پلی ساکارید، خواص مکانیکی هیدروژل حاصل میتواند دقیقاً کنترل شود. این هیدروژلهای آگارز کربوکسیل شده میتواند پس از آن بهطور کوانتومی به پپتیدها پیوند دهد تا هیدروژل را تشکیل دهد که سلولها میتوانند آن را حفظ کنند. این هیدروژلهای آگارز کربوکسیل شده نشان دادهاست که سازمان دهی سلولهای اندوتلیال انسان را به لومنهای پلاریزه هدایت میکند. مخلوط کردن آگارز بهطور کامل کربوکسیل شده با آگارز طبیعی میتواند برای تولید هیدروژلهایی که طیف وسیعی از خواص مکانیکی را پوشش میدهد استفاده شود.
برای اندازهگیری حرکت و تحرک میکروارگانیسم، آگارز گاهی به جای آگار استفاده میشود. گونههای متحرک قادر به مهاجرت، هر چند به آرامی، در سراسر ژل متخلخل، و سپس میزان نفوذ میتوانند تجسم یابد. تخلخل ژل بهطور مستقیم با غلظت آگار و آگارز در محیط همراه است، بنابراین ژلهای مختلف غلظت میتوانند برای شناخت شنا، سوخاری، تیرگی و تحریک حرکتی سلول مورد استفاده قرار گیرند. برای اندازهگیری کموتاکسیس و کوموکینیز، ممکن است از روش مهاجرت سلولهای زیر آگار استفاده شود. یک لایه ژل آگارز بین جمعیت سلولی و شیمیایی کشنده قرار میگیرد. به عنوان یک gradient غلظت از انتشار سیما کشنده به ژل توسعه مییابد، جمعیتهای مختلف سلولی که نیاز به سطوح مختلف تحریک برای مهاجرت دارند، میتوانند با استفاده از میکروفوتوگرافی در طول زمان تجسم شوند، به طوری که آنها از طریق ژل در برابر گرانش در امتداد گرادیان به سمت بالا حرکت میکنند.
محیط کشت جامد
آگارز صفحه گاهی اوقات ممکن است به جای استفاده از آگار برای کشت ارگانیسم به عنوان آگار ممکن است حاوی ناخالصی است که میتواند رشد باکتری یا برخی از پایین دست روش مانند روش واکنش زنجیرهای پلیمراز (PCR). آگارز نیز سختتر از آگار و بنابراین ممکن است ترجیح داده شده که در آن بیشتر ژل قدرت لازم است و آن پایینتر ژل متوسط ممکن است به جلوگیری از ایجاد شوک حرارتی به ارگانیسم هنگامی که سلولهای معلق در مایع قبل از ژل است. آن را ممکن است مورد استفاده برای فرهنگ سخت autotrophic باکتری گیاه protoplastهای[4] Caenorhabditis elegansبا[5] موجودات دیگر و مختلف سلولی است.
3D کشت سلولی
آگارز است که اغلب استفاده میشود به عنوان یک پشتیبانی از سه بعدی، فرهنگ حیوان و انسان و سلولهای. چون آگارز اشکال غیر سمی و هیدروژلمی توان آن را مورد استفاده برای تولید مثل محیط زیست طبیعی از سلولها در بدن انسان به ماتریکس خارج سلولی. اما آگارز اشکال سفت بی اثر هیدروژل که انجام هر گونه اطلاعات بیولوژیکی در نتیجه انسان و سلولهای حیوانی نمیتواند پایبند به پلی ساکارید. از آنجا که از این ویژگی خواص آگارز hydrogel شبیه محیط طبیعی غضروف سلول و نشان داده شدهاست به حمایت از تمایز سلولهای غضروف به غضروفاست. به منظور اصلاح خواص مکانیکی از pcr برای تکثیر طبیعی و محیط زیست از دیگر سلولهای انسان آگارز میتوان شیمیایی اصلاح شده از طریق دقیق اکسیداسیون اولیه الکل از D-گالاکتوز به کربوکسیلیک اسیداست. این تغییر شیمیایی را فراهم میکند یک رمان کلاس از مواد به نام carboxylated آگارز. از طریق کنترل بر تعدادی از carboxylated D-گالاکتوز در پلی ساکارید فقرات خواص مکانیکی حاصل از هیدروژل را میتوان دقیقاً کنترل میشود. این carboxylated آگارز هیدروژل میشود و سپس covalently باند به پپتید به شکل hydrogel که در آن سلول میتواند پایبند است. این carboxylated آگارز هیدروژل نشان داده شدهاست بهطور مستقیم این سازمان از انسان سلولهای اندوتلیال به قطبی لومن.[6] مخلوط بهطور کامل carboxylated آگارز با آگارز را میتوان مورد استفاده برای ایجاد هیدروژل است که دامنه وسیعی از خواص مکانیکی.[7][8]
تحرک سنجش
آگارز است که گاهی اوقات به جای استفاده از آگار به اندازهگیری میکروارگانیسم تحرک و تحرک است. متحرک گونه خواهد بود قادر به مهاجرت البته به آرامی در سراسر متخلخل ژل و نفوذ نرخ پس از آن میتواند تجسم. ژل را تخلخل بهطور مستقیم مربوط به غلظت آگار یا آگارز در رسانههای مختلف غلظت ژل ممکن است مورد استفاده برای ارزیابی یک سلول شنابا swarmingبا هواپیمای بی موتوری پرواز و کشش تحرک است. تحت آگارز مهاجرت سلول روش ممکن است مورد استفاده برای اندازهگیری chemotaxis و chemokinesis. یک لایه از ژل آگارز قرار داده شدهاست بین یک سلول جمعیت و chemoattractant. به عنوان یک گرادیان غلظت توسعه از انتشار از chemoattractant به ژل سلولهای مختلف جمعیتهای مختلف نیاز به تحریک سطح به مهاجرت پس از آن میتواند تجسم در طول زمان با استفاده از microphotography آنها به عنوان تونل به سمت بالا از طریق ژل در برابر گرانش در امتداد گرادیان.
جستارهای وابسته
- آگار
- SDD-سن
منابع
- Jeppson, J. O. , C. B. Laurell, and Bi Franzen (1979). "Agarose gel electrophoresis". Clinical Chemistry. 25 (4): 629–638. PMID 313856.CS1 maint: Multiple names: authors list (link)
- Agar بایگانیشده در اکتبر ۱۶, ۲۰۰۷ توسط Wayback Machine at lsbu.ac.uk Water Structure and Science
- Keren, David (26 September 2003). Protein Electrophoresis in Clinical Diagnosis. CRC Press. pp. 7–8. ISBN 978-0-340-81213-6.
- J.M. Bonga; Patrick von Aderkas (1992). In Vitro Culture of Trees. Springer. p. 16. ISBN 978-0-7923-1540-7.
- Guy A. Caldwell; Shelli N. Williams; Kim A. Caldwell (2006). Integrated Genomics: A Discovery-Based Laboratory Course. Wiley. pp. 94–95. ISBN 978-0-470-09502-7.
- A. Forget; J. Christensen; S. Lüdeke; E. Kohler; S. Tobias; M. Matloubi; R. Thomann; V. P. Shastri (2013). "Polysaccharide hydrogels with tunable stiffness and provasculogenic properties via α-helix to β-sheet switch in secondary structure". Proceedings of the National Academy of Sciences of the United States of America. 110 (32): 12887–12892. doi:10.1073/pnas.1222880110. PMC 3740890.
- A. Forget; R. A. Pique; V. Ahamadi; S. Lüdeke; V. P. Shastri (2015). "Mechanically tailored agarose hydrogels through molecular alloying with beta-sheet polysaccharides". Macromolecular Rapid Communications. 36 (2): 196–203. doi:10.1002/marc.201400353.
- A. Rüther; A. Forget; A. Roy; C. Carballo; F. Mießmer; R. K. Dukor; L. A. Nafie; C. Johannessen; V. P. Shastri (2017). "unravelling a direct role for polysaccharide beta-strands in the Higher Order Structure of Physical Hydrogels". Angewandte Chemie International Edition. 56: 1–6. doi:10.1002/anie.201701019.